题目内容
8.标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.6g,则混合气体平均相对分子质量为19;混合气体中甲烷的体积为6.72L;一氧化碳的质量为2.8g.分析 n(气体)=$\frac{8.96L}{22.4L/mol}$=0.4mol,结合M=$\frac{m}{n}$、m=nM、V=nVm及原子守恒计算.
解答 解:n(气体)=$\frac{8.96L}{22.4L/mol}$=0.4mol,其质量为7.6g,则混合气体平均相对分子质量为$\frac{7.6}{0.4}$=19,
设CO为xmol、甲烷为ymol,则
$\left\{\begin{array}{l}{x+y=0.4}\\{28x+16y=7.6}\end{array}\right.$
解得x=0.1mol,y=0.3mol,
甲烷的体积为0.3mol×22.4L/mol=6.72L;一氧化碳的质量为0.1mol×28g/mol=2.8g,
故答案为:19;6.72L;2.8g.
点评 本题考查物质的量的计算,为高频考点,把握物质的量、质量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意碳原子守恒的应用,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
14.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 医用酒精的浓度通常是95% | |
| B. | “玉兔号”月球车太阳能电池帆板的材料含硅 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | Al2O3和MgO的熔点均很高,可用于制作耐高温材料 |
19.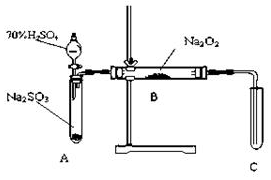 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了如图所示的装置进行实验制取SO2的反应.充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,作用产生二氧化硫没有干燥,水蒸气会与Na2O2反应.
②措施:为确保C中的实验现象发生,在B、C之间加一个装有NaOH溶液的洗气瓶,作用除去SO2气体防止污染空气.
(2)某同学推断该白色固体为Na2SO3,则其化学反应方程式是2Na2O2+2CO2=2Na2CO3+O2.
(3)任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3mol•L-1HCl、6mol•L-1HNO3、NaOH稀溶液、蒸馏水、1mol•L-1 BaCl2溶液、澄清石灰水、品红溶液.
①提出合理假设:
假设1:白色固体为Na2SO3; 假设2:白色固体为Na2SO4 ;
假设3:白色固体为Na2SO3与Na2SO4的混合物.
②设计实验方案证明以上三种假设,并按表格式写出实验操作步骤、预期现象与结论.
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入过量3mol•L-1的稀盐酸,塞上单孔胶塞,将生成的气体通入品红溶液. | 若有能使品红溶液褪色的无色气体生成,说明白色固体含有Na2SO3,则假设1或3成立,若无该现象,则假设2成立. |
| 步骤2:在步骤1反应后的溶液加入1mol•L-1BaCl2溶液. | 若有白色沉淀生成,则说明白色固体含Na2SO4. 结合步骤1的结论,则假设3成立,若无该现象,则假设1成立. |
16. 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
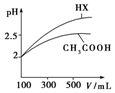
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
13.下列实验操作正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
18.用含钴废料(含CoCO3、少量NiCO3与铁屑)制备CoCl2•6H2O的工艺流程如图1:
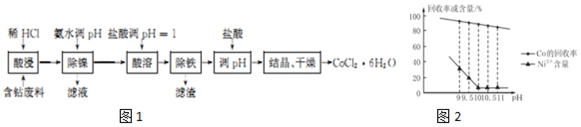
已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
(1)酸浸工艺中用“稀HCl”替代了传统的“盐酸与硝酸的混酸”,其优点为减少有毒气体氮氧化物的排放;防止产品中混有硝酸盐(或防止将Co2+氧化).
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.

已知:除镍过程中溶液pH对Co的冋收率影响如图2所示;部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表所示.
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
| Ni2+ | 6.7 | 9.5 |
(2)除镍时应调节pH=10;此步骤中Ni2+是否形成Ni(OH)2沉淀?否.
(3)除铁过程包括以下多个步骤:①向溶液中滴加适量30%H2O2,使其充分反应;②向溶液中加入CoCO3,调节溶液pH4.l≤pH<6.6,使Fe3+沉淀完全;③过滤得CoCl2溶液. (可供选用的试剂:30% H2O2、l.0mol•L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是抑制Co2+水解.
(5)工业上采用减压蒸干的方法制备CoCl2•6H2O,减压蒸干的目的是防止CoCl2•6H2O分解.
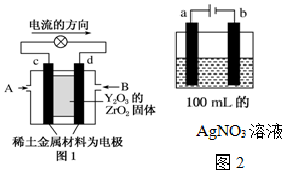 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-═2O2-).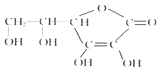 维生素C的结构简式如图所示:
维生素C的结构简式如图所示: 磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮杀虫剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: .
.