题目内容
2.已知:NaAlO2+NaHCO3+H2O═Na2CO3+Al(OH)3↓,向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
分析 CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序依次为:CO2+Ba(OH)2=BaCO3↓+H2O、2NaOH+CO2=Na2CO3+H2O、2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,若二氧化碳过量,还发生:Na2CO3+CO2+H2O=2NaHCO3、BaCO3+CO2+H2O=Ba(HCO3)2,以此来解答.
解答 解:A.通入2mol二氧化碳,先发生Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,由CO2+2NaOH=Na2CO3+H2O,剩余的1mol二氧化碳与2mol氢氧化钠反应恰好反应,则沉淀只有1mol,故A正确;
B.当通入的n(CO2)=3 mol时,
Ba(OH)2+CO2=BaCO3↓+H2O
1mol 1mol 1mol
2NaOH+CO2=Na2CO3+H2O
2mol 1mol
2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,
2mol (3-1-1)mol 2mol
所以产生的沉淀是BaCO3和Al(OH)3且n(沉淀)之和,为3mol(1mol BaCO3和2mol Al(OH)3),故B错误;
C.通入4mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,剩余3mol二氧化碳与氢氧化钠发生反应:CO2+NaOH=NaHCO3,消耗二氧化碳2mol,最后1mol二氧化碳与Na[Al(OH)4]发生反应2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,生成2mol氢氧化铝沉淀,故生成沉淀总物质的量为3mol,故C正确;
D.当通入6mol二氧化碳,分别发生反应Ba(OH)2+CO2=BaCO3↓+H2O,CO2+NaOH=NaHCO3,2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成1mol碳酸钡、2mol氢氧化铝沉淀,2mol碳酸氢钠,1mol碳酸钠,消耗4mol二氧化碳,剩余的2mol二氧化碳分别与生成的1mol碳酸钠和1mol碳酸钡沉淀发生反应:Na2CO3+CO2+H2O=2NaHCO3 ,BaCO3+CO2+H2O=Ba(HCO3)2,所以最后剩余沉淀的物质的量为2mol,故D正确;
故选B.
点评 本题考查混合物反应的计算,为高频考点,把握发生的反应及先后顺序为解答的关键,侧重分析与计算能力的考查,注意与量有关的反应,题目难度不大.

| A. | 摩尔是七个基本物理量之一 | |
| B. | 标准状况下,1 mol任何物质的体积都约为22.4L | |
| C. | CH4的摩尔质量为16g | |
| D. | 硫酸和磷酸的摩尔质量都是98g/mol |
| A. | 蒸馏完毕后,先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| B. | 向容量瓶转移液体时,引流的玻璃棒可以接触容量瓶内壁 | |
| C. | 将Cl2和HCl通入饱和食盐水可以得到纯净的Cl2 | |
| D. | 用排水集气法收集铜粉与稀硝酸反应产生的NO |
| A. | Na2SO4溶液和MgCl2溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | NaOH溶液和Fe(SO4)3溶液 | D. | Ca(OH)2溶液和盐酸 |
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(3)A、B、C、G四种元素的简单离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+.(用离子符号回答)
(4)F元素氢化物的化学式是H2O.该氢化物在常温下跟B单质发生反应的离子方程式2K+2H2O═2K++2OH-+H2↑;
(5)H元素的最高价含氧酸与G的最高价含氧酸比较酸性更强的是HClO4 (填化学式)
(6)G元素与H元素两者核电荷数之差是18:写出C元素原子结构示意图
 .
. | A. | 医用酒精的浓度通常是95% | |
| B. | “玉兔号”月球车太阳能电池帆板的材料含硅 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | Al2O3和MgO的熔点均很高,可用于制作耐高温材料 |
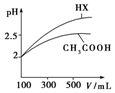 25℃时部分弱电解质的电离平衡常数数据如表所示:
25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:
a.CH3COONa B.Na2CO3 c.NaClO D.NaHCO3
pH由小到大排列顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是B、D.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D. $\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c•({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是加水稀释相同倍数,一元酸的pH变化越大,酸性越强,电离平衡常数越大.
(4)84消毒液(主要成分NaClO)在空气中变质的离子方程式为CO2+ClO-+H2O═HClO+HCO3-2HClO═2H++2Cl-+O2↑.
