题目内容
苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:
反应过程: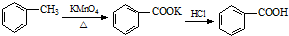
反应试剂、产物的物理常数:
注释:[1]100℃左右开始升华.
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出现 现象时,停止反应.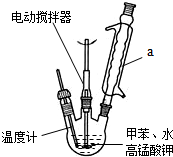 装置a的作用是 .
装置a的作用是 .
写出并配平该反应化学方程式:1 + KMnO4→1
+ KMnO4→1 + MnO2↓+1H2O+
+ MnO2↓+1H2O+
Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为 .
(2)趁热过滤、热水洗涤.趁热过滤目的是 .
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列 操作(填字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:
称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴 (填写“甲基橙”或“酚酞”),然后用0.1000mol?L-1 KOH溶液滴定,到达滴定终点时消耗KOH溶液24.00mL.产品中苯甲酸质量分数为 .
反应过程:

反应试剂、产物的物理常数:
| 名称 | 性状 | 熔点 (℃) | 沸点 (℃) | 密度 (g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
[2]苯甲酸在100g水中的溶解度为:4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:
按如图在250mL三颈烧瓶中放入2.7mL甲苯和100mL水,控制100℃机械搅拌溶液,在石棉网上加热至沸腾.从冷凝管上口分批加入8.5g高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约需4~5h,静置发现不再出现
 装置a的作用是
装置a的作用是写出并配平该反应化学方程式:1
 +
+ +
+Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液使紫色褪去,此时反应的离子方程式为
(2)趁热过滤、热水洗涤.趁热过滤目的是
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:
称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴
考点:制备实验方案的设计
专题:实验设计题
分析:I.(1)甲苯不溶于水会分层,反应生成的苯甲酸钾易溶于水;装置a能冷凝回流蒸汽;甲苯与高锰酸钾反应生成苯甲酸钾、二氧化锰、水和氢氧化钾,根据元素守恒配平方程式;
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾;
(2)过滤除去难溶性的二氧化锰,趁热过滤可以防止苯甲酸钾结晶析出;
(4)苯甲酸中的杂质为氯化钾,根据二者物理性质的差别分析;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用酚酞作指示剂;根据氢氧化钾的物质的量求出苯甲酸的物质的量,再求出质量和质量分数.
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾;
(2)过滤除去难溶性的二氧化锰,趁热过滤可以防止苯甲酸钾结晶析出;
(4)苯甲酸中的杂质为氯化钾,根据二者物理性质的差别分析;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用酚酞作指示剂;根据氢氧化钾的物质的量求出苯甲酸的物质的量,再求出质量和质量分数.
解答:
解:I.(1)甲苯不溶于水会分层,反应生成的苯甲酸钾易溶于水,所以反应后的混合溶液不再分层,说明甲苯完全反应;装置a能冷凝回流水蒸汽、甲苯蒸汽,防止甲苯的挥发而降低产品产率;甲苯与高锰酸钾反应生成苯甲酸钾、二氧化锰、水和氢氧化钾,反应方程式为: +2KMnO4
+2KMnO4
 +2MnO2↓+H2O+KOH;
+2MnO2↓+H2O+KOH;
故答案为:分层;将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率;2;2;1KOH;
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾生成二氧化锰、硫酸钾和水,其反应的离子方程式为:2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O;
故答案为:2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O;
(2)反应后的混合物中含有二氧化锰固体,过滤除去难溶性的二氧化锰,苯甲酸钾的溶解度随着温度的降低而减小,所以趁热过滤可以防止苯甲酸钾结晶析出;
故答案为:除去二氧化锰并防止苯甲酸钾结晶析出造成损失;
(4)苯甲酸中的杂质为氯化钾,苯甲酸易升华,KCl的熔沸点很高,不升华,所以提纯含有氯化钾的苯甲酸可以采用升华的方法;苯甲酸在水中的溶解度受温度影响较大,可以采用重结晶的方法提纯苯甲酸;
故答案为:BD;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用在碱性条件下变色的指示剂,所以选用酚酞作指示剂;
n(KOH)=cV=0.1000mol?L-1 ×0.024L=0.0024mol,苯甲酸与氢氧化钾等物质的量恰好反应,则n(苯甲酸)=0.0024mol,
则其总质量为0.0024mol×122g/mol×
=1.1712g,所以产品中苯甲酸质量分数为
×100%=96.00%,
故答案为:酚酞;96.00%.
 +2KMnO4
+2KMnO4| 加热 |
 +2MnO2↓+H2O+KOH;
+2MnO2↓+H2O+KOH;故答案为:分层;将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率;2;2;1KOH;
II.(1)亚硫酸氢钠均有还原性,能还原高锰酸钾生成二氧化锰、硫酸钾和水,其反应的离子方程式为:2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O;
故答案为:2MnO4-+3HSO3-+OH-=2MnO2↓+3SO42-+2 H2O;
(2)反应后的混合物中含有二氧化锰固体,过滤除去难溶性的二氧化锰,苯甲酸钾的溶解度随着温度的降低而减小,所以趁热过滤可以防止苯甲酸钾结晶析出;
故答案为:除去二氧化锰并防止苯甲酸钾结晶析出造成损失;
(4)苯甲酸中的杂质为氯化钾,苯甲酸易升华,KCl的熔沸点很高,不升华,所以提纯含有氯化钾的苯甲酸可以采用升华的方法;苯甲酸在水中的溶解度受温度影响较大,可以采用重结晶的方法提纯苯甲酸;
故答案为:BD;
III.苯甲酸与氢氧化钾反应生成苯甲酸钾,苯甲酸钾水解显碱性,应该用在碱性条件下变色的指示剂,所以选用酚酞作指示剂;
n(KOH)=cV=0.1000mol?L-1 ×0.024L=0.0024mol,苯甲酸与氢氧化钾等物质的量恰好反应,则n(苯甲酸)=0.0024mol,
则其总质量为0.0024mol×122g/mol×
| 100ml |
| 25ml |
| 1.1712g |
| 1.22g |
故答案为:酚酞;96.00%.
点评:本题考查了苯甲酸的制备实验方案设计,侧重于制备实验操作、物质的分离提纯、离子方程式的书写、数据的处理和计算、滴定原理的应用等知识点的考查,清楚制备的原理是解答的关键,题目难度中等.

练习册系列答案
相关题目
将一定量的锌与100mL 18.5mol?L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 16.8L(标准状况).将反应后的溶液稀释到1L,测得溶液的pH=0,则下列叙述中错误的是( )
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为4:1 |
| C、反应中共消耗锌97.5 g |
| D、反应中共转移电子1.5 mol |



 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
 ②
② (R、R′表示烃基)
(R、R′表示烃基)