题目内容
 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.(1)写出FeCl3溶液腐蚀印刷电路板的离子方程式
(2)若将(1)中的中的反应设计成原电池,请在如图的方框内画出带有盐桥的该原电池的装置示意图,并标出电极材料、电极名称及电解质溶液,写出发生还原反应的电极的电极反应式
(3)电解原理在化学工业中有广泛的应用,电镀就是电解原理的一种重要应用.如果要在金属铁表面镀一层铜,那么金属铁应与外接电源的
考点:电解原理,离子方程式的书写,电极反应和电池反应方程式
专题:
分析:(1)氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液;发生还原反应的电极为正极,据此书写电极反应式;
(3)依据电镀原理分析,镀层金属做阳极,待镀金属做阴极,含镀层金属离子的电解质溶液.
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液;发生还原反应的电极为正极,据此书写电极反应式;
(3)依据电镀原理分析,镀层金属做阳极,待镀金属做阴极,含镀层金属离子的电解质溶液.
解答:
解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: ;Fe3++e-=Fe2+;
;Fe3++e-=Fe2+;
(3)与电源正极相连的为电解池阳极,与电源负极相连的电极为电解池阴极,要在金属铁表面镀一层铜,镀层金属铜做阳极,待镀金属铁做阴极,含镀层金属离子Cu2+ 的电解质溶液作电解质溶液,阳极电极反应 Cu-2e-═Cu2+,故答案为:负极; 阳极;Cu2+;Cu-2e-═Cu2+.
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,故答案为:
,故答案为: ;Fe3++e-=Fe2+;
;Fe3++e-=Fe2+;(3)与电源正极相连的为电解池阳极,与电源负极相连的电极为电解池阴极,要在金属铁表面镀一层铜,镀层金属铜做阳极,待镀金属铁做阴极,含镀层金属离子Cu2+ 的电解质溶液作电解质溶液,阳极电极反应 Cu-2e-═Cu2+,故答案为:负极; 阳极;Cu2+;Cu-2e-═Cu2+.
点评:本题考查了原电池设计,知道哪些反应能设计成原电池,根据反应中元素化合价变化确定正负极、电解质溶液,原电池设计是学习难点,也是考试热点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
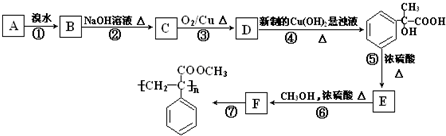
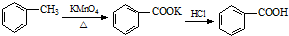
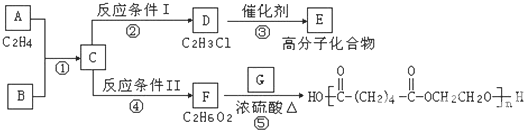
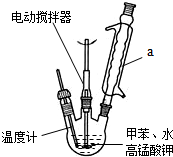 装置a的作用是
装置a的作用是 +
+ +
+
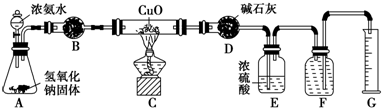 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题: 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):