题目内容
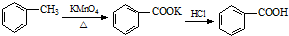
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气流从左到右的方向)是 → → → (填编号)
(3)实验时可观察到装置①中A瓶现象 ;C瓶现象 ;A瓶溶液的作用是 ;B瓶溶液的作用是 ;C瓶溶液的作用是 .
(4)装置②中所加的固体药品是 ,可验证的产物是 ,现象是 .
(5)装置③中所盛溶液是 ,可验证的产物是 .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气流从左到右的方向)是

(3)实验时可观察到装置①中A瓶现象
(4)装置②中所加的固体药品是
(5)装置③中所盛溶液是
考点:浓硫酸的性质实验
专题:实验题
分析:(1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O;
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2.
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2.
解答:
解:(1)在加热条件下,C和浓硫酸发生氧化还原反应生成CO2、SO2、H2O,反应方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水,装置排列顺序是气体制取装置、H2O检验装置、SO2检验装置、SO2吸收装置、SO2检验装置、CO2检验装置,所以排列顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,在排除SO2条件下将CO2通入澄清石灰水中检验CO2,所以①中A瓶现象是溶液褪色、C中溶液不褪色,A的作用是检验SO2、B的作用是吸收SO2、C的作用是检验SO2是否除尽,
故答案为:溶液褪色;溶液不褪色;检验SO2;吸收SO2;检验SO2是否除尽;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,所以检验水可以用无水硫酸铜晶体,看到的现象是白色固体变为蓝色,故答案为:无水硫酸铜;水;白色固体变蓝色;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2,所以③中所盛溶液澄清石灰水,验证的物质是CO2,故答案为:澄清石灰水;CO2.
| ||
| ||
(2)CO2、SO2两种气体都能使澄清石灰水变浑浊,但CO2、SO2的不同点是SO2具有漂白性和还原性,可以用品红溶液检验SO2、用酸性高锰酸钾溶液吸收SO2,在排除SO2条件下用澄清石灰水检验CO2,
该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,①中所有装置中都含有水,所以应该先检验水,装置排列顺序是气体制取装置、H2O检验装置、SO2检验装置、SO2吸收装置、SO2检验装置、CO2检验装置,所以排列顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)SO2能和品红溶液反应生成无色物质而使品红褪色,SO2能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,在排除SO2条件下将CO2通入澄清石灰水中检验CO2,所以①中A瓶现象是溶液褪色、C中溶液不褪色,A的作用是检验SO2、B的作用是吸收SO2、C的作用是检验SO2是否除尽,
故答案为:溶液褪色;溶液不褪色;检验SO2;吸收SO2;检验SO2是否除尽;
(4)该反应中还生成H2O,水能使无水硫酸铜固体变蓝色,所以检验水可以用无水硫酸铜晶体,看到的现象是白色固体变为蓝色,故答案为:无水硫酸铜;水;白色固体变蓝色;
(5)CO2能使澄清石灰水变浑浊,所以在排除SO2的条件下可以用澄清石灰水检验CO2,所以③中所盛溶液澄清石灰水,验证的物质是CO2,故答案为:澄清石灰水;CO2.
点评:本题以浓硫酸和碳的反应为载体考查性质实验方案设计,明确二氧化硫和二氧化碳性质的相似性和差异性即可解答,注意在检验二氧化碳之前要将二氧化硫除尽,为易错点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列属于电解质且能导电的是( )
| A、盐酸 | B、铜 |
| C、熔融的KCl | D、蔗糖 |
已知BaCO3和BaSO4溶度积常数分别为KSP=5.1×10-4,KSP=1.1×10-10,则BaSO4可作钡餐,BaCO3不可作钡餐的主要理由是( )
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、SO42-没有毒性CO32-有毒性 |
| C、BaSO4密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大,造成中毒 |
 装置a的作用是
装置a的作用是 +
+ +
+


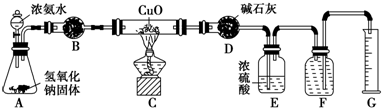 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题: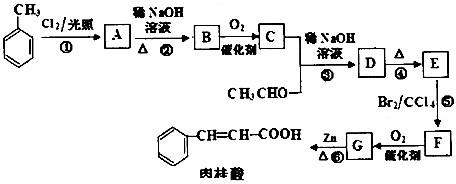
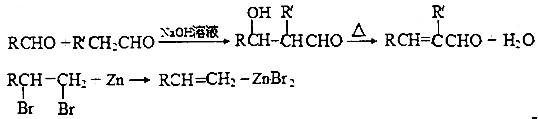
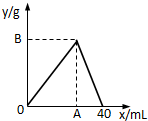 如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:
如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空: