题目内容
为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1g样品),请回答每个方案中的问题.
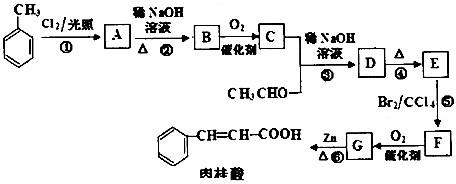
【方案Ⅰ】选用重量法进行测定:可用如图1中的装置进行实验.

(1)A装置中NaOH溶液的作用是 ,若直接向试样溶液中鼓人空气会导致实验测定结果 (填“偏高”、“偏低”或“无影响”)
(2)该方案需直接测定的物理量是 .
【方案Ⅱ】选用滴定法进行测定:
(3)称取m1g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
【方案Ⅲ】选用气体体积法进行测定:可用图2中的装置进行实验.
(4)为了减小实验误差,量气管中加入的液体X为
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的水面高于量气管的水面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
【方案IV】其操作流程如图3:
(6)操作Ⅱ的名称是
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是 ,
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果 (填“偏高”、“偏低”或“无影响”)
【方案Ⅰ】选用重量法进行测定:可用如图1中的装置进行实验.

(1)A装置中NaOH溶液的作用是
(2)该方案需直接测定的物理量是
【方案Ⅱ】选用滴定法进行测定:
(3)称取m1g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
【方案Ⅲ】选用气体体积法进行测定:可用图2中的装置进行实验.
(4)为了减小实验误差,量气管中加入的液体X为
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的水面高于量气管的水面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
【方案IV】其操作流程如图3:
(6)操作Ⅱ的名称是
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果
考点:探究物质的组成或测量物质的含量
专题:
分析:【方案Ⅰ】选用重量法进行测定:可用如图1中的装置进行实验.
(1)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量求碳酸氢钠的质量分数,故应排除空气中二氧化碳的干扰,若不吸收空气中的二氧化碳会导致测定结果偏高.
(2)需要直接测定的物理量是装置C反应前后的质量,其质量差即为二氧化碳的质量.
【方案Ⅱ】选用滴定法进行测定:
(3)根据化学方程式:NaHCO3+HCl═NaCl+CO2↑+H2O,可知反应消耗的盐酸与碳酸氢钠的物质的量相等;
(4)二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差.
(5)a项会使测定结果偏高;b项气体压强大于大气压,会使测定的体积偏小,导致碳酸氢钠的测定结果偏低;c项,原Y形管内有空气,后留有反应产生的气体不影响实验结果;本题是用排水集气法测定气体体积,不需要干燥,d项无影响.
【方案IV】其操作流程如图3:试样加入盐酸溶解过滤得到溶液转移到蒸发皿中加热蒸发结晶,冷却析出固体称量;
(6)依据分析可知操作Ⅱ是蒸发溶液得到晶体;
(7)需要得到溶质固体,实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是烧杯和酒精灯;
(8)在转移溶液时,如溶液转移不完全,称量得到氯化钠固体质量减小,计算得到碳酸氢钠质量分数增大;
(1)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量求碳酸氢钠的质量分数,故应排除空气中二氧化碳的干扰,若不吸收空气中的二氧化碳会导致测定结果偏高.
(2)需要直接测定的物理量是装置C反应前后的质量,其质量差即为二氧化碳的质量.
【方案Ⅱ】选用滴定法进行测定:
(3)根据化学方程式:NaHCO3+HCl═NaCl+CO2↑+H2O,可知反应消耗的盐酸与碳酸氢钠的物质的量相等;
(4)二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差.
(5)a项会使测定结果偏高;b项气体压强大于大气压,会使测定的体积偏小,导致碳酸氢钠的测定结果偏低;c项,原Y形管内有空气,后留有反应产生的气体不影响实验结果;本题是用排水集气法测定气体体积,不需要干燥,d项无影响.
【方案IV】其操作流程如图3:试样加入盐酸溶解过滤得到溶液转移到蒸发皿中加热蒸发结晶,冷却析出固体称量;
(6)依据分析可知操作Ⅱ是蒸发溶液得到晶体;
(7)需要得到溶质固体,实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是烧杯和酒精灯;
(8)在转移溶液时,如溶液转移不完全,称量得到氯化钠固体质量减小,计算得到碳酸氢钠质量分数增大;
解答:
解:【方案Ⅰ】选用重量法进行测定:可用如图1中的装置进行实验.
(1)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量求碳酸氢钠的质量分数,故应排除空气中二氧化碳的干扰,若不吸收空气中的二氧化碳会导致测定结果偏高;
故答案为:吸收空气中的CO2;偏高;
(2)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量来计算碳酸氢钠的质量,故需要直接测定的物理量是装置C反应前后的质量,其质量差即为二氧化碳的质量;
故答案为:装置C反应前后的质量;
【方案Ⅱ】选用滴定法进行测定:
(3)碳酸氢钠和盐酸反应方程式:
NaHCO3+HCl═NaCl+CO2↑+H2O,
84g 1mol
m cmol/L×VmL×10-3L/mol
m=
=84cV×10-3g,
碳酸氢钠的质量分数为:
×100%=
×100%.
故答案为:
×100%;
(4)二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差;故答案为:饱和NaHCO3;
(5)a、测定气体体积时未冷却至室温,由于热胀冷缩,导致所测体积偏大,会使测定结果偏高;
b、气体压强大于大气压,会使测定的体积偏小,导致碳酸氢钠的测定结果偏低;
c、原Y形管内有空气,后留有反应产生的气体不影响实验结果;
d、本题是用排水集气法测定气体体积,不需要干燥,d项无影响;
故选b;
【方案IV】其操作流程如图3:试样加入盐酸溶解过滤得到溶液转移到蒸发皿中加热蒸发结晶,冷却析出固体称量;
(6)依据分析可知操作Ⅱ是蒸发溶液得到晶体;
故答案为:蒸发;
(7)需要得到溶质固体,实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是烧杯和酒精灯;
故答案为:烧杯、酒精灯;
(8)在转移溶液时,如溶液转移不完全,称量得到氯化钠固体质量减小,计算得到碳酸氢钠质量分数增大;
故答案为:偏高;
(1)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量求碳酸氢钠的质量分数,故应排除空气中二氧化碳的干扰,若不吸收空气中的二氧化碳会导致测定结果偏高;
故答案为:吸收空气中的CO2;偏高;
(2)本题是通过碳酸氢钠与硫酸反应生成二氧化碳,再用碱石灰吸收二氧化碳,通过二氧化碳的质量来计算碳酸氢钠的质量,故需要直接测定的物理量是装置C反应前后的质量,其质量差即为二氧化碳的质量;
故答案为:装置C反应前后的质量;
【方案Ⅱ】选用滴定法进行测定:
(3)碳酸氢钠和盐酸反应方程式:
NaHCO3+HCl═NaCl+CO2↑+H2O,
84g 1mol
m cmol/L×VmL×10-3L/mol
m=
| 84g×cmol/L×Vml×10-3L/mol |
| 1mol |
碳酸氢钠的质量分数为:
84cV×10-3g×
| ||
| m1 |
| 0.42cV |
| m1 |
故答案为:
| 0.42cV |
| m1 |
(4)二氧化碳能溶于水,用饱和碳酸氢钠溶液可以降低二氧化碳的溶解度,减小实验误差;故答案为:饱和NaHCO3;
(5)a、测定气体体积时未冷却至室温,由于热胀冷缩,导致所测体积偏大,会使测定结果偏高;
b、气体压强大于大气压,会使测定的体积偏小,导致碳酸氢钠的测定结果偏低;
c、原Y形管内有空气,后留有反应产生的气体不影响实验结果;
d、本题是用排水集气法测定气体体积,不需要干燥,d项无影响;
故选b;
【方案IV】其操作流程如图3:试样加入盐酸溶解过滤得到溶液转移到蒸发皿中加热蒸发结晶,冷却析出固体称量;
(6)依据分析可知操作Ⅱ是蒸发溶液得到晶体;
故答案为:蒸发;
(7)需要得到溶质固体,实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是烧杯和酒精灯;
故答案为:烧杯、酒精灯;
(8)在转移溶液时,如溶液转移不完全,称量得到氯化钠固体质量减小,计算得到碳酸氢钠质量分数增大;
故答案为:偏高;
点评:本题考查较为综合,为高考常见题型,侧重于学生的分析能力、计算能力和实验能力的考查,注意把握物质的性质以及反应的实验原理,难度中等.通过本题我们要知道在完成实验时要尽可能的排除可能对实验结果产生影响的因素,例如本题中空气中二氧化碳对实验结果的影响,水蒸气的影响等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
250℃和1.01×105 Pa时,反应2XY3(g)═X2(g)+3Y2(g)△H=+56.76kJ/mol,自发进行的原因是( )
| A、熵增大效应大于能量效应 |
| B、是放热反应 |
| C、是熵减少的反应 |
| D、是吸热反应 |
下列属于电解质且能导电的是( )
| A、盐酸 | B、铜 |
| C、熔融的KCl | D、蔗糖 |
NaCl的晶胞如图所示,将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在晶胞的4个“小立方体”中心处各放置一个C原子,且这四个“小立方体”互不共面,位于“小立方体”中的碳原子均与最近的4个碳原子成键,以此表示金刚石的一个晶胞.若再将在成键的C院子中心联线的中点处增添一个O原子,则构成了某种CO2的晶胞.则下面说法正确的是( )(已知C-C键的键长1.54×10-10m)

| A、一个金刚石的晶胞中有8个C原子 |
| B、金刚石的密度为3.54g?cm-1 |
| C、在该种CO2晶体中,一个CO2分子由一个C原子和二个氧原子构成 |
| D、在该种CO2晶胞中含氧原子8个 |

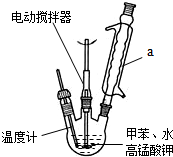 装置a的作用是
装置a的作用是 +
+ +
+