题目内容
12.以黄铜矿(主要成分CuFeS2)为原料制备CuSO4•5H2O的工艺流程示意图如下: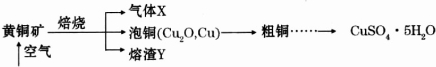
(1)某研究学习小组用如下装置由泡铜与CO反应来制取粗铜.
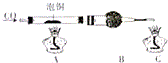
①装置B中的药品为碱石灰.
②实验时,依次进行如下操作:组装仪器、检查装置气密性、加装药品、通入气体、收集CO检验纯度、点燃酒精灯.
(2)炉渣X(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O.
b.选用提供的试剂验证炉渣中含有FeO.
提供的试剂:稀盐酸、稀硫酸、KSN溶液、KMnO4溶液、NaOH溶液、碘水.
所选的试剂为稀硫酸、KMnO4溶液.
(3)研究性学习小组用“间接碘量法”测定某试样CuSO4•5H2O(不含能与I-反应的氧化性杂质)的含量.取ag试样配成100mL溶液,每次取25.00mL,滴加KI溶液后有白色碘化物沉淀生成.写出该反应的离子方程式2Cu2++4I-=2CuI↓+I2.继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗cmol•L-1的Na2S2O3溶液VmL.则试样中CuSO4•5H2O的质量分数为$\frac{cV}{a}$×100%.
分析 黄铜矿在空气中焙烧后生成Cu2O、Cu、SO2以及熔渣,然后由Cu2O、Cu制得粗铜最终制得CuSO4•5H2O,所以X是SO2,
(1)①干燥管中吸收二氧化碳的为碱石灰;
②实验时,依次进行的操作为:组装仪器、检查装置气密性、加装药品、通入气体、收集CO检验纯度、点燃酒精灯;
(2)炉渣X(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3;用稀盐酸浸取炉渣,生成铁离子、亚铁离子、铝离子,二氧化硅不溶,过滤除去,加入氧化剂氧化亚铁离子为铁离子,加入过量氢氧化钠,铝离子生成偏铝酸根,铁离子生成氢氧化铁沉淀,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3,
a.除去Al3+要加过量的碱溶液,故离子方程式是Al3++4OH-=AlO2-+2H2O;
b.先加入稀硫酸溶液溶解,再加入KMnO4溶液,若褪色可证明;
(3)滴加KI溶液后有白色碘化物沉淀生成,说明反应中铜元素的化合价从+2价降为+1价,得到1个电子.而反应中碘离子失去电子被氧化生成单质碘,因此该反应的离子方程式为2Cu2++4I-=2CuI↓+I2;根据方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6可知:CuSO4•5H2O~Na2S2O3,计算试样中CuSO4•5H2O的物质的量,由此计算.
解答 解:(1)①用泡铜制取粗铜是利用CO与Cu2O反应来得到Cu,同时生成CO2,故装置B干燥管内应放碱石灰;
故答案为:碱石灰;
②实验时,依次进行的操作为:组装仪器、检查装置气密性、加装药品、通入气体、收集CO检验纯度、点燃酒精灯;
故答案为:检查装置气密性;收集CO检验纯度;
(2)a.除去Al3+要加过量的碱溶液,生成偏铝酸根离子,故离子方程式是Al3++4OH-=AlO2-+2H2O;
故答案为:Al3++4OH-=AlO2-+2H2O;
b.亚铁离子有还原性,先加入稀硫酸溶液溶解,再加入KMnO4溶液,若褪色可证明;
故答案为:稀硫酸、KMnO4溶液;
(3)滴加KI溶液后有白色碘化物沉淀生成,说明反应中铜元素的化合价从+2价降为+1价,得到1个电子.而反应中碘离子失去电子被氧化生成单质碘,因此该反应的离子方程式为2Cu2++4I-=2CuI↓+I2;
根据方程式2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6可知:CuSO4•5H2O~Na2S2O3,
所以ag试样中CuSO4•5H2O的物质的量为0.001cVmol×$\frac{100mL}{25mL}$=0.004cVmol,质量为0.004cVmol×250g/mol=cVg,因此试样中CuSO4•5H2O的质量分数为$\frac{cV}{a}$×100%;
故答案为:2Cu2++4I-=2CuI↓+I2;$\frac{cV}{a}$×100%.
点评 本题考查金属混合物的分离和提纯,涉及尾气处理、离子的检验、氧化还原反应的方程式书写以及滴定实验,关键是提取题中的信息,根据所学知识完成,本题难度中等.

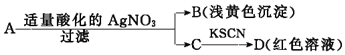
由此得出的结论中,不正确的是( )
| A. | D溶液中存在Fe(SCN)3 | B. | 滤液C中有Fe3+ | ||
| C. | B为AgBr | D. | A一定是FeBr2 |
| A. | 甲酸乙酯 | B. | 2-甲基丙烯酸乙酯 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 2-氯-2-甲基丙醛 |
| A. | 原子半径:Y>X | B. | 原子序数:Y>X | ||
| C. | 电子层数:Y>X | D. | 最外层电子数:Y>X |
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
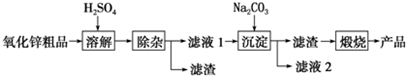
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.
| A. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(4x-y) kJ•mol | |
| B. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2x-y) kJ•mol-1 | |
| C. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2y-x) kJ•mol | |
| D. | 2SO2(g)+2KOH (l)═2KHSO3 (l)△H=-(8x-2y) kJ•mol-1 |
| A. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| B. | 该反应中反应物的总能量低于生成物的总能量 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
| A. | 金属铜制成纳米铜 | B. | 把水变成汽油 | ||
| C. | 热核聚变把氢原子变成氦原子 | D. | 干冰变成原子晶体 |