题目内容
16.某同学设计下列方法对A盐的水溶液进行鉴定: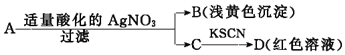
由此得出的结论中,不正确的是( )
| A. | D溶液中存在Fe(SCN)3 | B. | 滤液C中有Fe3+ | ||
| C. | B为AgBr | D. | A一定是FeBr2 |
分析 A中加入硝酸银生成浅黄色沉淀,为AgBr,应含有Br元素,C中滴加KSCN变红色,说明含有Fe元素,因硝酸根离子在酸性条件下具有强氧化性,不能确定A中是否含有Fe3+,可能含有Fe2+,以此解答该题.
解答 解:A中加入硝酸银生成浅黄色沉淀,B为AgBr,应含有Br元素,C中滴加KSCN变红色,说明含有Fe元素,滤液C中有Fe3+,D溶液中存在Fe(SCN)3,因硝酸根离子在酸性条件下具有强氧化性,不能确定A中是否含有Fe3+,可能含有Fe2+,
故选D.
点评 本题考查物质的检验和鉴别,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质,难度不大,注意实验的严密性和可行性的评价.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.恒温下,在2个体积相等的恒容密闭容器中反应2A(g)+B(g)?3C(g)达到平衡,若甲容 器起始投入2molA、1molB,乙容器起始投入1molC,下列说法正确的是( )
| A. | 两容器内压强一定相等 | B. | 两容器中A的浓度一定相等 | ||
| C. | 两容器吸收或放出的热量一定相等 | D. | 两容器中B的百分含量一定相同 |
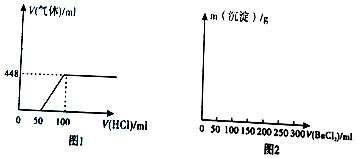
7.已知还原性:I->Br->Cl-,某溶液中含有大量的Cl-、Br-、I-、若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题.
(1)当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-=I2+2Cl-
(2)原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(l-) | amol | 0mol | 0mol |
(2)原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
4.下列化学用语正确的是( )
| A. | 某烷烃的命名为:2-甲基-3-乙基丁烷 | |
| B. | 羟基的电子式为: | |
| C. | 丙烷分子的球棍模型: | |
| D. | 丙酸的键线式: |
1.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 所有元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次减弱 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| D. | 熔融状态能导电的化合物一定含有离子键 |
8.下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | C(s)+O2(g)═CO2(g)△H=-285.5 kJ/mol |
5.NH3•H2O分子中NH3与H2O之间氢键表示为( )(填序号)
| A. | N-H••O | B. | O-H…N | C. | H-N…N | D. | H-O…H |