题目内容
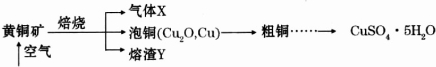
7.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如图: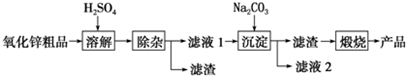
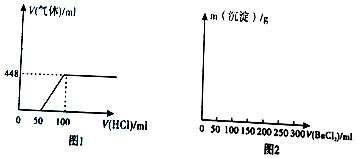
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.
分析 制备活性氧化锌流程为:氧化锌粗品中加入稀硫酸,通过过滤操作分离出不溶于酸的杂质,滤液中含有Zn2+、SO42-、Fe2+、Cu2+,酸化滤液后加入适量碳酸钠溶液得到沉淀ZnCO3•2Zn(OH)2•H2O,经过煅烧得到ZnO,
(1)根据增大接触面积可以加快反应的速率分析回答;
(2)Fe2+、Cu2+等杂质,均可与碳酸钠反应;适量KMnO4将Fe2+转化为Fe(OH)3,写反应根据化学计量数计算;
(3)根据锌能置换出溶液中的铜分析回答;
(4)根据“煅烧”ZnCO3•2Zn(OH)2•H2O的反应生成氧化锌、二氧化碳和水写出反应的化学方程式;
(5)氢氧化锌可溶于过量的氨水中,生成Zn(NH3)42+,据此书写;
(6)用相互滴加的实验方法时,如果所产生的实验结果不同,即可鉴别.
解答 解:(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大接触面积,加快反应速率.
故答案为:增大固液接触面积,加快溶解时的反应速率;
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质,需升高pH,加入Na2CO3 调节溶液的pH至5.4,使溶液的酸性减弱,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.在KMnO4中锰元素的化合价降低,该反应中作为氧化剂.调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2.反应的离子方程式为:
MnO4 -+3Fe2++7H2O=MnO2+3Fe(OH)3↓+5H+
1 3
n 1L×0.009mol•L-1
n=0.003mol,
故答案为:碳酸钠;0.003;
(3)由于制备活性氧化锌,杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉,
故答案为:锌粉;
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑;
故答案为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑;
(5)氢氧化锌溶于过量的氨水中,生成Zn(NH3)42+,氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-;
故答案为:Zn(OH)2+4NH3=Zn(NH3)42++2OH-;
(6)①硫酸铝中加氢氧化钠,先出现沉淀,然后沉淀消失,然后又出沉淀,向氢氧化钠中加硫酸铝没有现象,故用相互滴加的实验方法可以鉴别;
②硫酸铝和氨水不管是谁往谁中相互滴加是现象均是出现白色沉淀,用相互滴加的实验方法不可以鉴别;
③硫酸锌和碳酸钠不管是谁往谁中相互滴加是现象均是出现白色沉淀,用相互滴加的实验方法不可以鉴别;
④往硫酸锌中加氨水时,会出现白色沉淀,向氨水中加硫酸锌时,无现象,故用相互滴加的实验方法可以鉴别;
故答案为:①④.
点评 本题考查了物质的制备、分离和提纯方法的综合应用,应注意加强基础知识的学习和应用知识解决问题的能力的提高,考查学生分析和解决问题的能力,难度较大.

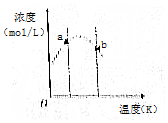 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |
| A. | 常用热的纯碱溶液清洗餐具上的油污 | |
| B. | “84”消毒液能漂白有色物质 | |
| C. | 常用消石灰改良酸性土壤 | |
| D. | 明矾、硫酸铁常用于净水 |
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
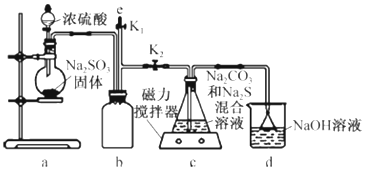
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体,硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
(1)如图实验装置中仪器乙的名称为:冷凝管.装置B的作用是防C中液体倒吸进A中(安全瓶).
(2)检验淀粉是否水解完全的方法:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,水解完全.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下对比实验;
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4•7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解.向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置.倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干.
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是取最后一次洗涤液1~2mL置于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
②用丙酮洗涤固体两次的目的是降低草酸亚铁的溶解量,同时更快洗去表面的水分.
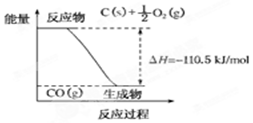
| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |