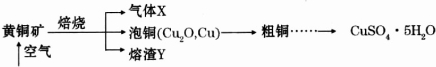
题目内容
4.在298K、1.01×105Pa下,将32g SO2通入750mL 1mol•L-1 KOH溶液中充分反应.测得反应放出x kJ的热量.已知在该条件下,1mol SO2通入1L 2mol•L-1KOH溶液中充分反应放出y kJ的热量.则 SO2与KOH溶液反应生成 KHSO3的热化学方程式正确的是( )| A. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(4x-y) kJ•mol | |
| B. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2x-y) kJ•mol-1 | |
| C. | SO2(g)+KOH (aq)═KHSO3 (aq)△H=-(2y-x) kJ•mol | |
| D. | 2SO2(g)+2KOH (l)═2KHSO3 (l)△H=-(8x-2y) kJ•mol-1 |
分析 在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L KOH溶液中充分反应,测得反应放出x kJ的热量,则2molSO2与3molKOH发生反应的热化学方程式为2SO2+3KOH=KHSO3+K2SO3+H2O△H=4xkJ/mol,1mol SO2通入1L 2mol/L KOH溶液中充分反应放出y kJ的热量,则1molSO2与2molKOH发生反应的热化学方程式为SO2+2KOH=K2SO3+H2O△H=ykJ/mol,根据盖斯定律答题.
解答 解:在298K、1.01×105Pa下,将32g SO2通入750mL 1mol/L KOH溶液中充分反应,测得反应放出x kJ的热量,则2molSO2与3molKOH发生反应的热化学方程式为①2SO2(g)+3KOH(aq)=KHSO3(aq)+K2SO3(aq)+H2O(l)△H=-4xkJ/mol,
1mol SO2通入1L 2mol/L KOH溶液中充分反应放出y kJ的热量,则1molSO2与2molKOH发生反应的热化学方程式为:②SO2(g)+2KOH(aq)=K2SO3(aq)+H2O(l)△H=-ykJ/mol,
根据盖斯定律将①-②得SO2与KOH溶液反应生成KHSO3的热化学方程式为SO2(g)+KOH(aq)=KHSO3(aq)△H=-(4x-y)kJ/mol,即SO2(g)+KOH(aq)=KHSO3(aq),△H=-(4x-y)kJ/mol,
故选A.
点评 本题考查反应热与焓变的应用,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
8.下列热化学方程式中△H的数值表示可燃物燃烧热的是( )
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | C(s)+O2(g)═CO2(g)△H=-285.5 kJ/mol |
9.化学与生产、生活密切相关.下列应用与盐类水解无关的是( )
| A. | 常用热的纯碱溶液清洗餐具上的油污 | |
| B. | “84”消毒液能漂白有色物质 | |
| C. | 常用消石灰改良酸性土壤 | |
| D. | 明矾、硫酸铁常用于净水 |
9.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 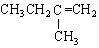 2-甲基丁烯 2-甲基丁烯 | D. | 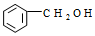 苯甲醇 苯甲醇 |
16.反应2C+O2═2CO的能量变化如图所示.下列说法正确的是( )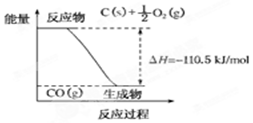

| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
13.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
14.下列说法不正确的是( )
| A. | 1molCO2含有6.02×1023个原子 | |
| B. | 1molNa2CO3的质量为106g | |
| C. | Na+的摩尔质量等于23g/mol | |
| D. | 0.012kg12C中碳原子数约为6.02×1023个 |