题目内容
9. 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)<c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
分析 A.一水合氨为弱碱,电离出c(OH-)<1.000mol/L;
B.b点显碱性,且盐酸不足;
C.c点为中性,则c(OH-)=c(H+),且c(OH-)+c(Cl-)=c(NH4+)+c(H+);
D.中和反应为放热反应,一水合氨电离为吸热反应,但d点后盐酸过量.
解答 解:A.一水合氨为弱碱,电离出c(OH-)<1.000mol/L,常温下Kw=1.0×10-14,则a点:由水电离出的c(H+)>1.0×10-14mol•L-1,故A正确;
B.b点显碱性,且盐酸不足,则b点:c(NH4+)+c(NH3•H2O)>c(Cl-),故B正确;
C.c点为中性,则c(OH-)=c(H+),且c(OH-)+c(Cl-)=c(NH4+)+c(H+),则c(Cl-)=c(NH4+),故C错误;
D.中和反应为放热反应,一水合氨电离为吸热反应,d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选CD.
点评 本题考查酸碱中和滴定,为高频考点,把握酸碱反应及图象分析为解答本题的关键,侧重分析与应用能力的考查,注意电荷守恒应用及d点温度变化为解答的难点,题目难度不大.

练习册系列答案
相关题目
18.无色透明溶液中能大量共存的离子组是( )
| A. | Na+、Al3+、HCO3-、NO3- | B. | Fe3+、SCN-、Cl-、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
19.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 |
| B | 0.05molNaHSO4 | c(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl | 溶液中性,水的电离程度减小 |
| D | 50mLH2O | 由水电离出的c(H+)•c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
4.第三周期元素R,它的原子最外电子层达到稳定结构所所需的电子数少于次外层与最内层电子数之差,且等于最内层电子数的整数倍,关于R的叙述中正确的是( )
| A. | R的气态氢化物的水溶液具有强酸性 | |
| B. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| C. | R是金属元素 | |
| D. | R的气态氢化物不能在氧气中燃烧 |
14.两种气态单质按下列反应X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应放热反应.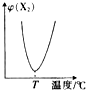

1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 28 g氮气所含的原子数目为NA | |
| B. | 4 g金属钙变成离子时失去的电子数目为0.1NA | |
| C. | 22.4 L CH4的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4 L CH4和氧气的混合物所含的分子数为NA |
18.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1mol氯气发生化学反应,转移的电子数必为2NA | |
| D. | CH4的摩尔质量与NA个CH4分子的质量在数值上相等 |
19.足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入下列物质中的是( )
| A. | H2O | B. | NaOH | C. | K2CO3 | D. | CH3COONa |