题目内容
14.两种气态单质按下列反应X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应放热反应.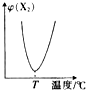
分析 由图可知,T之前X的体积分数从最大逐渐降低,而T之后X的体积分数增大,说明T之前是反应没有达到平衡状态,而T点时恰好平衡,T点之后是温度升高使平衡向左移动,以此解答该题.
解答 解:由图可知,T之前X的体积分数从最大逐渐降低,而T之后X的体积分数增大,说明T之前是反应没有达到平衡状态,而T点时恰好平衡,T点之后是温度升高使平衡向左移动,所以该反应是放热反应,
故答案为:放热反应.
点评 本题考查化学平衡图象、温度对化学平衡的影响,为高频考点,侧重考查学生的分析能力,难度中等,明确图象中含量随温度的平衡关系判断T点时恰好平衡是解题关键.

练习册系列答案
相关题目
3.常温时,用0.01mol/L H2SO4滴定0.01mol/LNaOH溶液,中和后加水至100mL,若滴定时终点判断有误差:①多加1滴HH2SO4②少加1滴H2SO4 (设1滴为0.05mL)则①和②H+浓度的比值是( )
| A. | 10 | B. | 50 | C. | 5×l03 | D. | 104 |
5.在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g),在2L的密闭容器中把4mol A和2mol B混合,2min后反应达到平衡时生成1.6mol C,又测得D的浓度为0.4mol•L-1.则下列说法不正确的是( )
| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
2.下列是有关0.1mol/L醋酸钡溶液微粒浓度的比较,其中错误的是( )
| A. | c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+) | B. | c(H+)+c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(OH-)═c(H+)+c(CH3COO-) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
9. 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)<c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
19.X、Y、Z、W是短周期元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | Y的阳离子半径比W的阴离子半径小 | |
| C. | X、Z、W最高价氧化物对应水化物酸性的强弱顺序为X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液其pH<7 |
3.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下.22.4LH2S和SO2的混合气体中含有的分子总数为NA | |
| B. | 1L1mol•L-1FeCl3溶液完全水解产生的Fe(OH)3胶体粒子数为NA | |
| C. | 高温下.16.8gFe与足量的水蒸气完全反应失去的电子数为0.8NA | |
| D. | 28.6gNa2CO3•10H2O溶于水配成1L溶液.该溶液中阴离子数目为0.1NA |
4.下列叙述正确的是( )
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1 mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | PH=2的酸HA溶液与PH=12的碱BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸 |
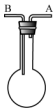 利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr
利用如图装置收集以下气体:①H2、②Cl2、③CH4、④HCl、⑤HBr