题目内容
19.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 |
| B | 0.05molNaHSO4 | c(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl | 溶液中性,水的电离程度减小 |
| D | 50mLH2O | 由水电离出的c(H+)•c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,加入0.05molCH3COONa,溶解醋酸根离子浓度增大,钠离子浓度为原来的2倍,水解程度减小;
B.加入NaHSO4溶解,加入的那离子物质的量和硫酸根离子物质的量相同,原溶液中存在物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH);
C.加入氯化铵铵根离子水解程度和草酸根离子水解程度相同溶液呈中性,水的电离程度增大;
D.加入50mLH2O稀释促进醋酸根离子水解,溶液中水电离出的氢氧根离子浓度减小.
解答 解:A.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,加入0.05molCH3COONa,溶解醋酸根离子浓度增大水解程度减小,草酸根浓度大于钠离子浓度为原来的2倍,比值增大,故A正确;
B.加入NaHSO4溶解,加入的那离子物质的量和硫酸根离子物质的量相同,c(Na+)=c(SO42-),原溶液中存在物料守恒c(Na+)=c(CH3COO-)+c(CH3COOH),混合溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-),故B正确;
C.加入氯化铵铵根离子水解程度和醋酸根离子水解程度相同溶液呈中性,水的电离程度增大,故C错误;
D.加入50mLH2O稀释促进醋酸根离子水解,溶液中水电离出的氢氧根离子浓度减小,氢离子浓度减小,由水电离出的c(H+)•c(OH-)减小,故D正确;
故选C.
点评 本题考查了盐类水解原理、电解质溶液中电荷守恒和物料守恒分析、弱电解质电离平衡影响因素等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
9.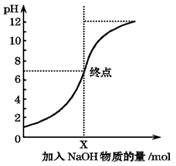 如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
 如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )
如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( )| A. | 原来盐酸的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的浓度为0.1mol/L | |
| C. | pH=1和pH=7的点对应溶液中水的电离程度相同 | |
| D. | X点NaOH溶液的体积为100mL |
10.下列物质的水溶液因水解而呈酸性的是( )
| A. | NaHSO4 | B. | NH4Cl | C. | SO2 | D. | H2SO4 |
7.下列说法不正确的是( )
| A. | 运用蒸馏的方法,可以分离沸点相差较大的固体混合物 | |
| B. | 铁的化合物应用十分广泛,如FeCl3、FeSO4是优良的净水剂 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 工业上以氯气和石灰乳为原料制造漂白粉,漂白粉主要成分为Ca(ClO)2和CaCl2 |
14.能与Al反应生成H2的透明溶液中可能大量共存的一组离子是( )
| A. | K+、NO3-、AlO2-、Na+ | B. | NH4+、SO42-、CO32-、NO3- | ||
| C. | Mg2+、Fe3+、Cl-、SCN- | D. | K+、Ca+、Cl-、HCO3- |
5.在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g),在2L的密闭容器中把4mol A和2mol B混合,2min后反应达到平衡时生成1.6mol C,又测得D的浓度为0.4mol•L-1.则下列说法不正确的是( )
| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
12.下列说法正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | HNO3的摩尔质量是63g | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| D. | 1mol氧含6.02×1023个O2 |
9. 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00 mL 1.000mol•L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)<c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
10.下列物质间不能发生离子反应的是( )
| A. | Na2SO4溶液与BaCl2溶液 | B. | NaOH溶液和稀H2SO4溶液 | ||
| C. | NaCl溶液与KNO3溶液 | D. | Na2CO3溶液与稀盐酸 |