题目内容
3.实验室制取氯气的反应为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;其中这个反应中的氧化剂为:MnO2;还原剂为:HCl;还原剂与氧化产物的物质的量之比为:2:1;当生成3.36L的气体(标准状况下测得)时转移的电子数为:0.3mol.分析 MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,结合氧化还原反应中基本概念来解答.
解答 解:Mn元素的化合价降低,则得到电子被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,由方程式可知,4molHCl参加反应,有2mol被氧化,生成1mol氯气,则还原剂与氧化产物的物质的量之比为2:1,生成3.36L的气体,物质的量为0.15mol,转移0.3mol电子,
故答案为:MnO2;HCl;2:1;0.3mol.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 铜与浓硝酸的反应:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
14.下列说法正确的是( )
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 已知反应:2CO(g)=2C(s)+O2(g)的△H>0,△S<0,那么高温下可自发进行 |
11.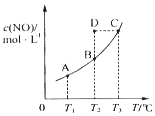 在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
 在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )
在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)?CO2(g)+N2(g),平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是( )| A. | 该反应的△H>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB | |
| D. | 在T2时,若 反 应 体 系 处于 状 态D,则 此 时 v正>v逆 |
18.下列涉及的有机物及有机反应类型正确的是( )
| A. | 乙烯分子与苯分子均含碳碳双键,都能发生加成反应 | |
| B. | 除去甲烷气体中的乙烯可将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 | |
| C. | 实验室可用溴水鉴别苯、乙醇和环己烯 | |
| D. | 乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
8.下列说法正确的是( )
| A. | 氮气的化学性质不活泼,是因为氮元素不活泼 | |
| B. | 雷雨可以增加土壤中硝酸盐类氮肥的含量,此过程中的反应都属于氮的固定 | |
| C. | 氮气可替代稀有气体作焊接金属的保护气 | |
| D. | NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |
15.下列指定反应的离子方程式正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:A13++4NH3•H2O═A1O2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
12.已知位于第四周期的A、B两种元素,其原子的M层电子数不同,且A原子的N层电子数比B原子的N层电子数少1个,下列说法正确的是( )
| A. | B原子的M层电子一定比A原子的M层电子多 | |
| B. | B原子的外围电子数一定比A原子的外围电子数多 | |
| C. | A、B元素一定是副族元素,另一种是主族元素 | |
| D. | A、B元素可能都是主族元素,也可能都是副族元素 |
16.下列各溶液中,c(Na+)最大的是( )
| A. | 4 L 0.5mol/L的NaCl溶液 | B. | 2 L 0.8mol/L的NaOH溶液 | ||
| C. | 1 L 1mol/L的Na2CO3溶液 | D. | 0.5 L 1.2mol/L的Na2SO4溶液 |