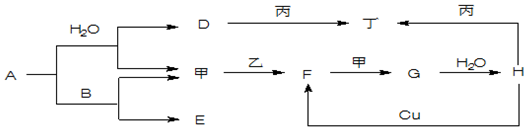
题目内容
13.正确表示下列反应的离子方程式的是( )| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 铜与浓硝酸的反应:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.氯气足量,亚铁离子和溴离子都被氧化;
C.氢氧化钠过量,反应生成碳酸钙沉淀、碳酸钠和水;
D.浓硝酸中的硝酸需要拆开,不能保留分子式.
解答 解:A.将Cl2通入氯化亚铁溶液,反应生成氯化铁,正确的离子方程式为:2 Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.向FeBr2溶液中通入足量氯气,反应生成氯化铁、溴单质,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B正确;
C.少量Ca(HCO3)2溶液与过量NaOH溶液反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故C错误;
D.铜与浓硝酸的反应中,硝酸需要拆开,正确的离子方程式为:Cu+4H++2NO3-=Cu 2++2NO2↑+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
18.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+ H+ SO42- HCO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、NH4+、NO3-、OH- |
19.已知a是一种常见单质,可发生如图所示的转化关系,则下列叙述中不正确的是( )
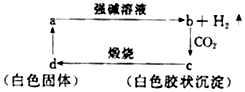

| A. | a在与强碱溶液的反应中氧化剂是强碱 | |
| B. | 向b中滴加适量盐酸可得到c | |
| C. | c不一定是两性物质 | |
| D. | d一定能和氢氧化钠溶液反应 |
1.下列说法正确的是( )
| A. | 硅、锗都位于金属与非金属的交界处,都可以做半导体材料 | |
| B. | 氢化物的沸点:H2O>NH3>HF | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
2.下列说法不正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:①>③>② |
 .
.