题目内容
8.下列说法正确的是( )| A. | 氮气的化学性质不活泼,是因为氮元素不活泼 | |
| B. | 雷雨可以增加土壤中硝酸盐类氮肥的含量,此过程中的反应都属于氮的固定 | |
| C. | 氮气可替代稀有气体作焊接金属的保护气 | |
| D. | NO2溶于水生成硝酸,因此NO2是硝酸的酸酐 |
分析 A.氮气中含N≡N,键能大,性质稳定,氮元素属于较活泼的非金属元素;
B.雷雨时,空气中的氮气转化为NO;
C.氮气化学性质稳定,性质决定用途;
D.酸酐与对应酸中中心元素的化合价相同.
解答 解:A.氮气中含N≡N,键能大,性质稳定,而氮元素是活泼的非金属元素,故A错误;
B.雷雨时,空气中的氮气转化为NO,属于氮的固定,故B错误;
C.氮气化学性质稳定,不易与其它物质发生化学反应,常作为焊接金属时的保护气,故C正确;
D.酸酐与对应酸中中心元素的化合价相同,NO2溶于水生成硝酸,但硝酸的酸酐是N2O5,故D错误;
故选C.
点评 本题考查氮气的性质,为高频考点,把握物质的性质、性质与用途、相关概念为解答的关键,侧重分析与应用能力的考查,注意氮的固定,题目难度不大.

练习册系列答案
相关题目
19.某化学反应2A?B+D在四种不同条件下进行.B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:?
(1)在实验1中,反应在10至20min时间内反应物A的平均速率为0.013.
(2)在实验2中,反应经20min就达到平衡,可推测实验2中还隐含的条件是加入催化剂.??
| 实验 序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 820℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
(1)在实验1中,反应在10至20min时间内反应物A的平均速率为0.013.
(2)在实验2中,反应经20min就达到平衡,可推测实验2中还隐含的条件是加入催化剂.??
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25°C,pH=2的HCl溶液中含有H+的数目为0.01NA | |
| B. | 1mol$NH_4^+$中含有10NA个质子 | |
| C. | 1mol碳烯(:CH2)中含有的电子数8NA | |
| D. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
13.下列碳酸盐中最易分解为氧化物的是( )
| A. | CaCO3 | B. | BaCO3 | C. | MgCO3 | D. | SrCO3 |
20.下列化学用语书写正确的是( )
| A. | 镁离子的结构示意图: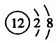 | B. | 苯甲酸乙酯的结构简式: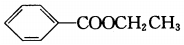 | ||
| C. | CO2的电子式: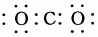 | D. | 中子数为18的氯原子:${\;}_{17}^{18}$Cl |
17.在恒温恒容容器中体积比2:1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是( )
| A. | CO的浓度保持恒定 | B. | 混合气体的平均分子量逐渐减少 | ||
| C. | CO和NO的物质的量之比逐渐增大 | D. | v(CO):v(NO):v(N2)=2:2:1 |
1.下列离子方程式中,正确的是( )
| A. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ | |
| C. | 铁与硫酸铁反应:Fe+Fe3+=2Fe2+ | |
| D. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
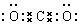 .
.