题目内容
14.下列说法正确的是( )| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 已知反应:2CO(g)=2C(s)+O2(g)的△H>0,△S<0,那么高温下可自发进行 |
分析 A.手机上用的锂离子电池属于可充电电池;
B.增大压强,活化分子的百分数不变;
C.升高温度,可增大活化分子的百分数;
D.如能自发进行,应满足△H-T•△S<0.
解答 解:A.手机上用的锂离子电池属于可充电电池,为二次电池,一次电池不能充电,故A错误;
B.增大压强,单位体积活化分子数目增大,但活化分子的百分数不变,故B错误;
C.升高温度,使更多的分子转化为活化分子,可增大活化分子的百分数,有效碰撞次数增多,反应速率增大,故C正确;
D.反应:2CO(g)=2C(s)+O2(g)的△H>0,△S<0,则高温下△H-T•△S>0,不能自发进行,故D错误.
故选C.
点评 本题考查较为综合,涉及化学反应与能量变化、化学反应速率的影响等问题,为高频考点,侧重考查学生的分析能力,注意相关知识的学习和积累,难度不大.

练习册系列答案
相关题目
19.已知a是一种常见单质,可发生如图所示的转化关系,则下列叙述中不正确的是( )
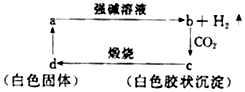

| A. | a在与强碱溶液的反应中氧化剂是强碱 | |
| B. | 向b中滴加适量盐酸可得到c | |
| C. | c不一定是两性物质 | |
| D. | d一定能和氢氧化钠溶液反应 |
2.下列说法不正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:①>③>② |
9.将足量浓HCl、浓HNO3、浓H2SO4按顺序分别滴在三张蓝色的石蕊试纸上,三张纸最终变成( )
| A. | 红、白、黑 | B. | 红、蓝、黑 | C. | 红、黑、红 | D. | 红、红、红 |
19.某化学反应2A?B+D在四种不同条件下进行.B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:?
(1)在实验1中,反应在10至20min时间内反应物A的平均速率为0.013.
(2)在实验2中,反应经20min就达到平衡,可推测实验2中还隐含的条件是加入催化剂.??
| 实验 序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 820℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
(1)在实验1中,反应在10至20min时间内反应物A的平均速率为0.013.
(2)在实验2中,反应经20min就达到平衡,可推测实验2中还隐含的条件是加入催化剂.??
6.下列说法正确的是( )
| A. | 金属阳离子被还原时不一定得到金属单质 | |
| B. | 非金属元素的最高价含氧酸都具有强氧化性 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 直径介于1nm~100nm之间的微粒成为胶体 |
7.已知25℃时,Ksp(BaSO4)=1.1×10-10.则在5.0%的Na2SO4溶液中(假设溶液的密度为1g•cm-3),Ba2+的最大浓度是( )
| A. | 4.2×10-10 mol•L-1 | B. | 8.4×10-10 mol•L-1 | ||
| C. | 3.1×10-10 mol•L-1 | D. | 5.8×10-10 mol•L-1 |