题目内容
12.已知位于第四周期的A、B两种元素,其原子的M层电子数不同,且A原子的N层电子数比B原子的N层电子数少1个,下列说法正确的是( )| A. | B原子的M层电子一定比A原子的M层电子多 | |
| B. | B原子的外围电子数一定比A原子的外围电子数多 | |
| C. | A、B元素一定是副族元素,另一种是主族元素 | |
| D. | A、B元素可能都是主族元素,也可能都是副族元素 |
分析 第四周期中M层电子数不同,A原子的N层电子数比B原子的N层电子数少1个,常见元素有Ca和Ga,为主族元素,副族元素有Cr、Cu和Fe、Co、Ni、Zn等,以此解答该题.
解答 解:A.如为Cu和Ti,则Cu的N层电子数比Ti少,但Cu的M层电子数多,故A错误;
B.如A为Cu,B为Fe等,则B原子的外围电子数一定比A原子的外围电子数少,故B错误;
C.A、B可都为副族元素,故C错误;
D.由分析可知A、B元素可能都是主族元素,也可能都是副族元素,故D正确.
故选D.
点评 本题考查原子结构与元素周期表的关系,为高频考点,答题时要逐步确定A、B的电子层数和各层上的电子数,把排布规律与题意结合起来,整体把握,难度不大.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
2.下列说法不正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为:①>③>② |
20.下列化学用语书写正确的是( )
| A. | 镁离子的结构示意图: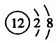 | B. | 苯甲酸乙酯的结构简式: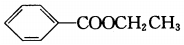 | ||
| C. | CO2的电子式: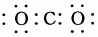 | D. | 中子数为18的氯原子:${\;}_{17}^{18}$Cl |
7.氢化铝钠由于具有储氢性能而备受关注,它可用氢化物、铝、高压氢在烃或醚溶剂中反应制得:2NaH+2Al+3H2=2NaAlH4.下列说法正确的是( )
| A. | NaAH4中氢元素的化合价为+1价 | |
| B. | 若有1 mol NaAl4生成,则转移4 mol电子 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为3:2 | |
| D. | 氢化铝钠溶于水时除有气泡产生外,还有大量的白色沉淀生成 |
17.在恒温恒容容器中体积比2:1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是( )
| A. | CO的浓度保持恒定 | B. | 混合气体的平均分子量逐渐减少 | ||
| C. | CO和NO的物质的量之比逐渐增大 | D. | v(CO):v(NO):v(N2)=2:2:1 |
7.已知25℃时,Ksp(BaSO4)=1.1×10-10.则在5.0%的Na2SO4溶液中(假设溶液的密度为1g•cm-3),Ba2+的最大浓度是( )
| A. | 4.2×10-10 mol•L-1 | B. | 8.4×10-10 mol•L-1 | ||
| C. | 3.1×10-10 mol•L-1 | D. | 5.8×10-10 mol•L-1 |
4.下列实验中,对应的现象及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeBr2溶液中滴入KSCN溶液,再滴入1mL苯和少量氯水,振荡 | 苯层呈橙色,下层呈无色 | Cl2的氧化性强于Br2 |
| B | 向饱和食盐水中通入CO2至饱和 | 溶液中有白色沉淀 | 白色沉淀为NaHCO3 |
| C | 向酸性碘酸钾溶液中加入淀粉,再缓慢通入过量SO2 | 溶液先变蓝,后蓝色又褪去 | 氧化性:IO3->I2>SO2 |
| D | 足量的铝条加入热的浓硫酸中,然后冷却至室温 | 无气体产生 | 铝在浓硫酸中钝化 |
| A. | A | B. | B | C. | C | D. | D |
5.下列有关实验操作正确或能达到预期目的是( )
| A. |  点燃酒精灯 | B. |  制备并检验氢气的可燃性 | ||
| C. |  海带灼烧成灰 | D. |  液体加热 |