题目内容
15.工业上制取硝酸铵的流程图如图1所示.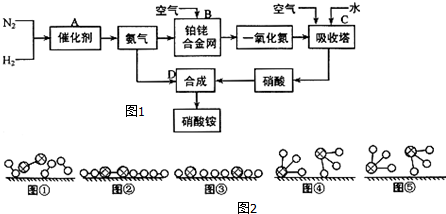
请回答下列问题:
(1)在合成氨的生产中,A设备的名称为合成塔,N2与H2合成NH3所用的催化剂是铁触媒.2007年化学家格哈德•埃特尔研究证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如图2.
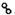 、
、 、
、 分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.(2)合成氨时,假设100L氮气与氢气(体积比为1:3)的混合气体充分反应后,体积变为90L,则氮气的转化率为20%.
(3)在上述工业生产中,B装置的名称为氧化炉,B中发生反应的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(4)已知1m3硝酸工业的尾气中含3160mgNOx,其中n(NO):n(NO2)=9:1.如果在通入空气的情况下,用NaOH溶液完全吸收NOx生成NaNO3,则发生反应的化学方程式为10NaOH+7O2+9NO+NO2═10NaNO3+5H2O,至少需要25%的NaOH溶液(密度1.28g/cm3)12.5mL(结构保留三位有效数字).
(5)已知以上硝酸工业的尾气NOx还可以用氨氧混合气进行处理,写出以上尾气NOx与氨气反应的化学方程式22NH3+27NO+3NO2═26N2+33H2O.
分析 (1)合成塔是N2与H2合成NH3的设备,所用的催化剂是铁触媒;图②中两种双原子分子被吸附在催化剂表面;③中分子中的化学键断裂生成原子;
(2)根据反应方程式N2+3H2?2NH3,根据体积的变化求反应的氮气的体积,然后根据转化率为=$\frac{变化量}{起始量}$;
(3)氨气在氧化炉中被催化氧化;氨气被氧化为NO和水;
(4)NaOH溶液与尾气n(NO):n(NO2)=9:1在氧气的作用下反应生成NaNO3和水,根据氧化还原反应得失电子守恒写出方程式;设混合气体中含有xmolNO,ymolNO2,依据题中条件n(NO):n(NO2)=9:1,及总质量为3160mg,计算两种气体的物质的量,根据化学反应方程式中氢氧化钠与气体的比例关系计算出氢氧化钠的物质的量,结合c=$\frac{1000ρω}{M}$计算出质量分数为25%、密度为1.28g/cm3的氢氧化钠的浓度,最后用V=$\frac{n}{c}$计算体积;
(5)尾气NOx与氨气发生归中反应生成氮气.
解答 解:(1)合成塔是N2与H2合成NH3的设备,所用的催化剂是铁触媒;图②中两种双原子分子被吸附在催化剂表面,即N2、H2被吸附在催化剂表面;③中分子中的化学键断裂生成原子,即在催化剂表面N2、H2中的化学键断裂生成N原子和H原子,
故答案为:合成塔;铁触媒;N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂;
(2)根据反应方程式N2+3H2?2NH3 △V,
1 2
V变 100-90
所以V变=$\frac{100-90}{2}$=5L,
所以转化率为=$\frac{变化量}{起始量}$=$\frac{5L}{100L×\frac{1}{4}}$=20%,
故答案为:20%;
(3)氨气在氧化炉中被催化氧化,B设备的名称是;氨气被氧化为NO和水,其反应的方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:氧化炉;4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)NaOH溶液与尾气n(NO):n(NO2)=9:1在氧气的作用下反应生成NaNO3和水,反应方程式为:10NaOH+7O2+9NO+NO2═10NaNO3+5H2O,
由题意可知n(NO):n(NO2)=9:1,及总质量为3160mg,设混合气体中含有xmolNO,ymolNO2,
则:x:y=9:1;30x+46y=3.16;解得x=0.09;y=0.01;
则氢氧化钠的物质的量为0.1mol,氢氧化钠的物质的量浓度c=$\frac{1000ρω}{M}$=$\frac{1000×1.28×25%}{40}$mol/L=8mol/L,则氢氧化钠的体积为:V=$\frac{n}{c}$=$\frac{0.1mol}{8mol/L}$=0.0125L=12.5mL,
故答案为:10NaOH+7O2+9NO+NO2═10NaNO3+5H2O;12.5mL;
(5)尾气NOx与氨气发生归中反应生成氮气,反应方程式为:22NH3+27NO+3NO2═26N2+33H2O,
故答案为:22NH3+27NO+3NO2═26N2+33H2O.
点评 本题考查了工业制备氨气的原理应用,流程分析,按题中信息准确书写氧化还原反应方程式,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.

| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH;
(3)按要求写出下列两种物质的电子式:①的氢化物
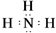 ;⑨的最高价氧化物的对应的水化物的电子式
;⑨的最高价氧化物的对应的水化物的电子式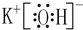 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑦形成的化合物的形成过程
 .
. | A. | 都是轻金属 | B. | 都是活泼金属 | ||
| C. | 成本低廉 | D. | 这些金属的化合物熔点较低 |
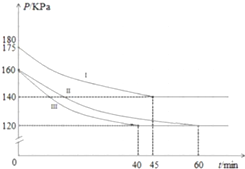 在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )
在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )| A. | 在实验Ⅲ中,从反应开始至达到平衡时,v(Cl2)=2.5×10-4mol/(L•min) | |
| B. | 实验Ⅲ跟实验Ⅱ相比,实验Ⅲ使用了催化剂 | |
| C. | 在实验Ⅱ中,反应的平衡常数K=100 | |
| D. | 该反应的△H>0 |
| 反应前各物质的物质的量/mol | |||
| A | B | C | |
| 甲 | 6 | 2 | 0 |
| 乙 | 0 | 0 | 6 |
| 丙 | 6 | 2 | 6 |
| A. | 带大平衡时,丙中A的溶度是甲中的2倍 | |
| B. | 若反应开始时向容器中加入A为2mol,B为0.5mol,C为3mol,则反应v(正)>v(逆) | |
| C. | 到达平衡时,甲中A的转化率等于乙中C的转化率 | |
| D. | 若保持恒温恒压,达到平衡后再向乙容器中再充入2molC,C的百分含量不变 |