题目内容
3.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期.X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6.N是短周期主族元素中原子半径最大的非金属元素.(1)请写出下列元素的元素符号:XO,MH,NSi.
(2)请写出下列反应的离子方程式:单质Y与Ca(OH)2溶液反应:Cl2+2OH-=Cl-+ClO-+H2O.
(3)Z的最高价氧化物的水化物的化学式H2SO4.
分析 X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,以此解答该题.
解答 解:X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y的最高化合价与其最低化合价的代数和等于6,处于ⅦA族,且Y、Z同周期,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,
(1)由上述分析可知,X为O元素,M为Cl元素,N为Si元素,故答案为:O、H、Si
(2)Y为Cl,单质Y与Ca(OH)2溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O,
(3)Z为S元素,对应的最高价氧化物的水化物的化学式为H2SO4,故答案为:H2SO4.
点评 本本题考查结构性质位置关系综合应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原子结构与元素周期率的递变规律,把握物质的性质的相似性和递变性,难度中等.

练习册系列答案
相关题目
14.某粒子用${\;}_Z^A{X^{n-}}$表示,下列关于该粒子的叙述错误的是( )
| A. | 质子数=A-n | B. | 中子数=A-Z | C. | 电子数=Z+n | D. | 所带电荷数=n |
11.某课外活动小组为探究金属与浓硫酸反应,进行了如下实验.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)
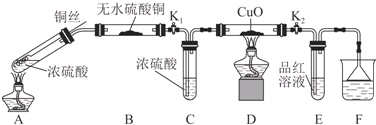
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
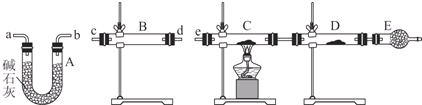
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
①无水硫酸铜
②固体由白色变成蓝色
③SO2中含有水蒸气
④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色
⑤SO2中含有氢气.
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)

(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).

(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
②固体由白色变成蓝色
③SO2中含有水蒸气
④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色
⑤SO2中含有氢气.
8.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池组成是( )
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
12.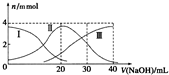 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
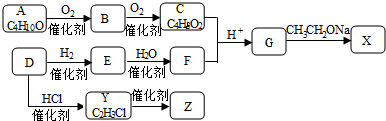
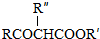
 ;
; ,反应类型是取代反应;
,反应类型是取代反应;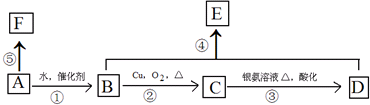
 .
.
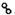 、
、 、
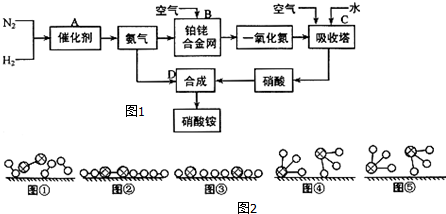
、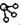 分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.