题目内容
20.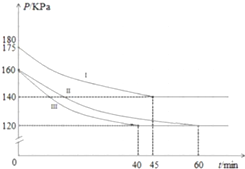 在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )
在10L恒容密闭容器中充入PCl3(g)和Cl2(g),发生反应:PCl3(g)+Cl2(g)?PCl5(g)起始时,PCl3(g)和Cl2(g)均为0.2mol,反应分别在Ⅰ、Ⅱ、Ⅲ三种条件下进行,其体系总压强随时间的变化如图所示.下列说法不正确的是( )| A. | 在实验Ⅲ中,从反应开始至达到平衡时,v(Cl2)=2.5×10-4mol/(L•min) | |
| B. | 实验Ⅲ跟实验Ⅱ相比,实验Ⅲ使用了催化剂 | |
| C. | 在实验Ⅱ中,反应的平衡常数K=100 | |
| D. | 该反应的△H>0 |
分析 气体压强之比等于气体物质的量之比,结合化学平衡三段式列式计算,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,则x=0.1mol,然后依据化学反应速率概念计算;
B.实验Ⅲ跟实验Ⅱ相比,达到相同平衡状态,但时间不同,Ⅲ组改变的实验条件及判断依据是加入了催化剂改变了反应速率;
C.ⅢⅡ是相同平衡状态,平衡时Ⅲ与Ⅱ的各组分的浓度相同,先计算出各组分浓度,然后根据平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算;
D.Ⅰ混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大.
解答 解:恒温恒容条件下,气体压强之比等于气体物质的量之比,设得到平衡状态时消耗PCl3物质的量为x,
PCl3(g)+Cl2(g)?PCl5(g)
起始量(mol) 0.2 0.2 0
变化量(mol) x x x
平衡量(mol) 0.2-x 0.2-x x
A.图象分析可知实验b气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,则实验b从反应开始至达到平衡时的反应速率为:v(Cl2)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{10L}}{60min}$=1.7×10-4mol/L•min,故A错误;
B.分析图象可知达到平衡状态的时间不同,时间越短反应速率越快,图中3组实验从反应开始至达到平衡时的反应速率v(PCl3)由大到小的次序Ⅲ>Ⅱ>Ⅰ,实验Ⅲ跟实验Ⅱ相比,达到相同平衡状态,但时间不同,Ⅲ组改变的实验条件及判断依据是加入了催化剂改变了反应速率,故B正确;
C.Ⅲ与Ⅱ是相同平衡状态,平衡时各组分的浓度相同,图象分析可知实验Ⅱ气体压强160变化为120,60min达到平衡状态,气体压强之比等于气体物质的量之比,0.4:(0.4-x)=160:120,解得:x=0.1mol,平衡浓度分别为:c( PCl3)=0.01mol/L,c(Cl2)=0.01mol/L,c(PCl5)=0.01mol/L,所以实验a条件下的平衡常数K=$\frac{0.01}{0.01×0.01}$=100,故C正确;
D.Ⅰ混合气体压强增大,达到平衡时间缩短,所以是升温引起的压强增大,但平衡分压减小,故升温平衡向正向移动,正向为吸热反应,故D正确.
故选A.
点评 本题考查了化学平衡的图象及计算,题目难度中等,明确恒温恒容条件下气体物质的量与压强之间的关系为解答关键,注意掌握化学平衡状态特征及应用,试题培养了学生的分析能力及化学计算能力.

| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示.(固定装置已略去)
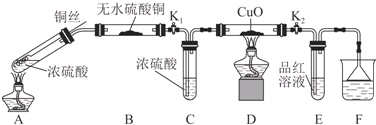
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
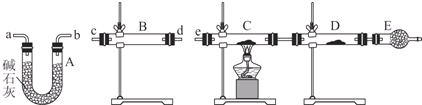
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
②固体由白色变成蓝色
③SO2中含有水蒸气
④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色
⑤SO2中含有氢气.
| A. | 正极为铜,负极为铁,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
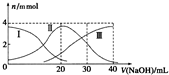 常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )
常温下,向20mlH2A溶液中滴加相同物质的量浓度NaOH溶液,有关微粒物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),下列说法正确的是( )| A. | H2A在水中电离方程式为:H2A?2H++A2- | |
| B. | V(NaOH)=20ml时,溶液呈酸性 | |
| C. | V(NaOH)=30mL时,溶液中有以下关系:c(A2-)+c(H2A)+c(HA-)=c(Na+) | |
| D. | V(NaOH)=40mL时,溶液中有以下关系:c(H+)+c(HA-)+c(H2A)=c(OH-) |
| 选项 | U | W | Y | X | 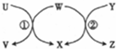 |
| A | Fe | H20 | C | H2 | |
| B | Na | H2O | Na2O2 | NaOH | |
| C | HBr | Cl2 | CH4 | HCl | |
| D | Fe3O4 | Al | NaOH | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
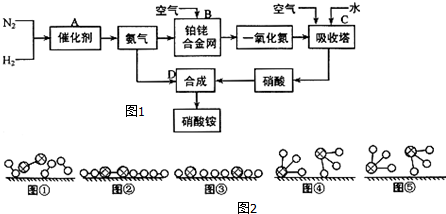
 、
、 、
、 分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示H2、N2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.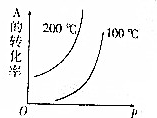 对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答: