题目内容
3. 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).已知:①反应过程中的能量变化如图所示;
②达到平衡时,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol.请回答下列问题.
(1)图中A点表示反应物具有的总能量;C点表示生成物具有的总能量.
(2)该反应通常使用以铁为主体的复合催化剂,使用该催化剂时,B点的变化是降低(填“升高”或“降低”).
(3)该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
分析 (1)从能量变化图可知A、C点的含义,A为反应物能量,C为生成物能量;
(2)从催化剂对活化能的影响分析,降低反应的活化能加快反应速率;
(3)达到平衡时,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,由求得放出18.4KJ能量物质的量的变化,进而求得按化学计量数反应的热效应,从而写出热化学方程式.
解答 解:(1)从能量变化图可知,A点代表反应物具有的总能量,C点代表生成物具有的总能量,
故答案为:反应物具有的总能量,生成物具有的总能量;
(2)使用催化剂,降低了反应所需活化能,活化分子百分数增加,反应速率加快,
故答案为:降低;
(3)根据方程式计算△H
物质的量变化为:1+3-3.6=0.4,放出18.4KJ能量,物质的量变化为:1+3-2=2时,对应的能量变化为X
N2(g)+3H2(g)?2NH3(g)△n∽Q
1 3 2 2 X
0.4 0.4 18.4
X=$\frac{2×18.4}{0.4}$=92,即△H=-92kJ/moL.
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/moL.
点评 本题综合考察了反应热与化学平衡的计算题.巧妙运用差量法可快速求解,题目难度中等.

练习册系列答案
相关题目
8.下列各组物质中,含原子数最多的是( )
| A. | 标准状况下5.6L 氢气 | B. | 6.02×1022个H2SO4 | ||
| C. | 11gCO2 | D. | 4℃时9mL水 |
9.电动自行车给人们带来了极大的方便,其电池为铅蓄电池,PbO2作为铅蓄电池的重要原料有广泛的用途.己知:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O,下列说法正确的是( )
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
6.用NA表示阿伏伽德罗常数的值,则下列说法正确的是( )
| A. | 2NA个H2与O2恰好反应,消耗氧气的体积约是22.4L | |
| B. | 1molC12与足量Fe反应,转移的电子数为3NA | |
| C. | 0.1molNaHSO4固体中,共含有0.2 NA个离子 | |
| D. | 在标准状况下,lLpH=13的NaOH溶液中,含有0.1NA个OH-(不考虑水的电离) |
13.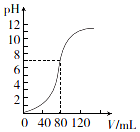 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
8.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ 滴定时,1mol(CH2)6N4H+与lmolH+相当,然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:步骤I 称取样品1.500g.
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时,用去NaOH标准溶液的体积将无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mol•L-1则该样品中氮的质量分数为18.85%.
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时,用去NaOH标准溶液的体积将无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
15.TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.某化学实验小组以8.0g TiO2和足量 CCl4为原料制取TiCl4.装置图1如下:
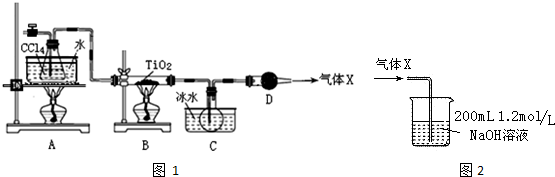
表是有关物质的性质:
请回答下列问题
(1)TiCl4中化学键的类型是共价键.
(2)B中TiO2发生反应的化学方程式是TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(3)X气体的主要成分是CO2.
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是排尽系统(装置)中的空气.
(5)欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
(6)若将反应过程中生成的气体X全部通入到图2所示的装置中充分反应,生成的盐是Na2CO3(填化学式),生成盐的总物质的量n≤0.1mol.

表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)TiCl4中化学键的类型是共价键.
(2)B中TiO2发生反应的化学方程式是TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(3)X气体的主要成分是CO2.
(4)实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是排尽系统(装置)中的空气.
(5)欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
(6)若将反应过程中生成的气体X全部通入到图2所示的装置中充分反应,生成的盐是Na2CO3(填化学式),生成盐的总物质的量n≤0.1mol.
12.某化学小组以苯甲酸的粗产品作为原料(含少量溶解度随温度变化影响较小的可溶物以及泥沙),提纯获得纯净的苯甲酸,再进行制取苯甲酸甲酯的实验.已知苯甲酸的溶解度如下表:
I.提纯苯甲酸产品
某同学为了提纯某苯甲酸样品,进行了如下实验:
(1)室温时,取少量样品放入烧杯,加入100mL蒸馏水充分搅拌,发现样品几乎没溶解;将烧杯放在石棉网上加热,待样品充分溶解后,再加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是滤除去不溶于水的杂质,并避免溶质因温度降低析出而造成损失;将所得滤液冷却至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体;
II.合成苯甲酸甲酯粗产品(已知部分物质的沸点如下表)
在烧瓶中加入12.2g 苯甲酸和20mL 甲醇(密度约0.79g•mL-1),再小心加入3mL 浓硫酸,混匀后,投人几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(2)浓硫酸的作用是催化剂和吸水剂;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:C6H5-CO18OH+CH3OH?C6H5-COOCH3+H218O;
(3)甲和乙两位同学分别设计了如图1两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).选择适当的装置(甲或乙),并说明你选择理由甲中有冷凝回流装置_;若要提高苯甲酸甲酯的产率,可采取的措施及时分离出产物苯甲酸甲酯(答案合理即可);(至少写出一条措施).
III.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图如图2进行精制.
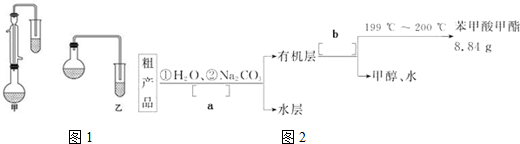
(4)以上流程图a、b所代表的实验操作为a:分液b:蒸馏;
(5)通过计算,苯甲酸甲酯的产率为65.0%(保留两位有效数字).
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
某同学为了提纯某苯甲酸样品,进行了如下实验:
(1)室温时,取少量样品放入烧杯,加入100mL蒸馏水充分搅拌,发现样品几乎没溶解;将烧杯放在石棉网上加热,待样品充分溶解后,再加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是滤除去不溶于水的杂质,并避免溶质因温度降低析出而造成损失;将所得滤液冷却至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体;
II.合成苯甲酸甲酯粗产品(已知部分物质的沸点如下表)
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(2)浓硫酸的作用是催化剂和吸水剂;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:C6H5-CO18OH+CH3OH?C6H5-COOCH3+H218O;
(3)甲和乙两位同学分别设计了如图1两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).选择适当的装置(甲或乙),并说明你选择理由甲中有冷凝回流装置_;若要提高苯甲酸甲酯的产率,可采取的措施及时分离出产物苯甲酸甲酯(答案合理即可);(至少写出一条措施).
III.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图如图2进行精制.

(4)以上流程图a、b所代表的实验操作为a:分液b:蒸馏;
(5)通过计算,苯甲酸甲酯的产率为65.0%(保留两位有效数字).