题目内容
8.下列各组物质中,含原子数最多的是( )| A. | 标准状况下5.6L 氢气 | B. | 6.02×1022个H2SO4 | ||
| C. | 11gCO2 | D. | 4℃时9mL水 |
分析 A、根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量;
B、根据n=$\frac{N}{{N}_{A}}$;
C、根据n=$\frac{m}{M}$;
D、根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量;结合分子含有原子数目计算含有原子总物质的量,据此判断.
解答 解:A、标况下,5.6L氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,所以原子总物质的量为0.5mol;
B、6.02×1022个H2SO4的物质的量为0.1mol,所以原子总物质的量为0.7mol;
C、11gCO2的物质的量为0.25mol,所以原子总物质的量为0.75mol;
D、9mL水的质量为9g,其物质的量为0.5mol,含有原子为0.5mol×3=1.5mol;
所以4℃时9mL水所含原子总数最多,
故选D.
点评 本题考查物质的量有关计算,注意微粒数目的计算的方法,比较基础,难度中等.

练习册系列答案
相关题目
18.FeCO3与砂糖混用可作补血剂,也能被用来制备Fe2O3.
(1)实验室制备FeCO3的流程如下:
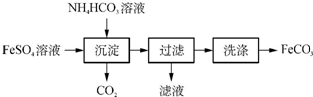
①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
根据上述现象得到化学方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.
(1)实验室制备FeCO3的流程如下:

①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.
3.下列说法正确的是( )
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
20.下列物质中,属于纯净物的是( )
| A. | 明矾 | B. | 铝热剂 | C. | 赤铁矿 | D. | 不锈钢 |
17.1mol•L-1Na2SO4溶液的含义是( )
| A. | 1L溶液中含142gNa2SO4 | B. | 1L溶液中含有1molNa+ | ||
| C. | 将142gNa2SO4溶于1L水中配成溶液 | D. | 1L水中含有1molNa2SO4 |
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.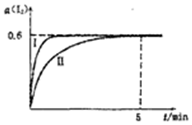 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).