题目内容
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂HIn(红色溶液)?H+(溶液)+In-(黄色溶液)
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
| A、②⑤⑥ | B、①④⑤ |
| C、①④⑦ | D、①④⑤⑦ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,以此解答该题.
解答:
解:能使指示剂显红色,应使c(HIn)>c(In-),所加入物质应使平衡向逆反应方向移动,所加入溶液应呈酸性,
①④⑦为酸性溶液,可使平衡向逆反应方向移动,溶液变红色;
②⑤⑥溶液呈碱性,可使平衡向正反应方向移动;
③为中性溶液,平衡不移动;
所以能使指示剂显红色的是①④⑦;
故选C.
①④⑦为酸性溶液,可使平衡向逆反应方向移动,溶液变红色;
②⑤⑥溶液呈碱性,可使平衡向正反应方向移动;
③为中性溶液,平衡不移动;
所以能使指示剂显红色的是①④⑦;
故选C.
点评:本题考查化学平衡的影响因素,题目难度不大,注意根据颜色的变化判断平衡移动的移动方向,结合外界条件对平衡移动的影响分析.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列性质不是由氢键引起的( )
| A、水的熔点比硫化氢高 |
| B、H-F的键能很大 |
| C、乙醇与水能以任意比例混溶 |
| D、冰的密度比水小 |
在2L的密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),有如下数据:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A、正反应为吸热反应 | ||
| B、实验1中,CO的转化率为80% | ||
C、650℃时,化学平衡常数K=
| ||
| D、实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
下列反应:①Na+H2O②Na2O+H2O③NO2+H2O ④Cl2+H2O⑤F2+H2O⑥SO2+H2O中,属于氧化还原反应,但水既不是氧化剂,又不是还原剂的是( )
| A、①③ | B、②⑥ | C、③④ | D、④⑤ |
下列叙述正确的是( )
| A、常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、常温下,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
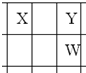 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |
抗生素是能抑制某些微生物生长的一类物质,最早发现的一种天然抗生素是( )
| A、青霉素 | B、阿司匹林 |
| C、红霉素 | D、吗啡 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| 催化剂 |
| A、增加压强 |
| B、升高温度 |
| C、增大H2O的浓度 |
| D、更换催化剂 |