题目内容
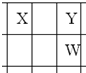 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示.下列说法正确的是( )| A、五种元素中,原子半径最大的是W |
| B、Y的简单阴离子比W的简单阴离子还原性强 |
| C、Y与Z形成的化合物都可以和盐酸反应 |
| D、X与Q形成的化合物是离子化合物 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.W的单质是黄色固体,则W为S,可推知Q为Cl,由X、Y、W在周期表中的相对位置,可知X为C、Y为O,其中只有Z是金属,则Z可能为Na或Mg或Al,据此解答.
解答:
解:X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.W的单质是黄色固体,则W为S,可推知Q为Cl,由X、Y、W在周期表中的相对位置,可知X为C、Y为O,其中只有Z是金属,则Z可能为Na或Mg或Al,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Z>W>Q>X>Y,故A错误;
B.S2-离子比O2-离子多1个电子层,故原子半径:S2->O2-,故B错误;
C.氧化钠、过氧化钠、氧化镁、氧化铝都能与盐酸反应,故C正确;
D.X与Q形成的化合物为CCl4,属于共价化合物,故D错误,
故选C.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Z>W>Q>X>Y,故A错误;
B.S2-离子比O2-离子多1个电子层,故原子半径:S2->O2-,故B错误;
C.氧化钠、过氧化钠、氧化镁、氧化铝都能与盐酸反应,故C正确;
D.X与Q形成的化合物为CCl4,属于共价化合物,故D错误,
故选C.
点评:本题考查结构性质位置关系应用,根据W单质的颜色推断各元素是解题关键,注意Z元素的不确定性,难度不大.

练习册系列答案
相关题目
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①与②中c(H+)相同 |
| B、①与④混合,溶液中c(CH3COO-)=c(Na+) |
| C、②和③混合,所得混合溶液的pH等于7 |
| D、③与④分别用等浓度的盐酸中和,消耗盐酸的体积相同 |
依照阿伏加德罗定律,下列叙述不正确的是( )
| A、同温同压下,两种气体的体积之比等于物质的量之比 |
| B、同温同压下,两种气体的体积之比等于分子数之比 |
| C、同温同压下,两种气体的物质的量之比等于摩尔质量之比 |
| D、同温同体积下,两种气体的物质的量之比等于压强之比 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂HIn(红色溶液)?H+(溶液)+In-(黄色溶液)
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
| A、②⑤⑥ | B、①④⑤ |
| C、①④⑦ | D、①④⑤⑦ |
 已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ?mol-1,金刚石的燃烧热为395.41kJ?mol-1.下列说法或表达正确的是( )
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.51kJ?mol-1,金刚石的燃烧热为395.41kJ?mol-1.下列说法或表达正确的是( )| A、金刚石比石墨稳定 |
| B、△H1<△H2 |
| C、如果使用催化剂,△H1和△H2都变小 |
| D、C(s、石墨)=C(s、金刚石)△H=+1.9 kJ?mol-1 |
下列离子方程式正确的是( )
| A、工业制取漂白粉:2Cl2+4OH-=2Cl-+2ClO-+2H2O | ||
B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO
| ||
| C、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | ||
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+3D2↑ |
下列物质只能作还原剂的是( )
| A、Fe |
| B、Fe2+ |
| C、Fe3+ |
| D、H+ |