题目内容
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| 催化剂 |
| A、增加压强 |
| B、升高温度 |
| C、增大H2O的浓度 |
| D、更换催化剂 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、反应前后气体体积不变,增大压强不改变平衡;
B、反应是放热反应,升温平衡逆向进行;
C、增大水蒸气浓度平衡正向进行;
D、更换催化剂,改变反应速率不改变化学平衡.
B、反应是放热反应,升温平衡逆向进行;
C、增大水蒸气浓度平衡正向进行;
D、更换催化剂,改变反应速率不改变化学平衡.
解答:
解:A、CO(g)+H2O(g)
CO2(g)+H2(g)是一个气体总体积不发生改变的反应,增大压强平衡不移动,CO的转化率不变,故A错误;
B、反应是放热反应,升高温度平衡向吸热方向移动,平衡逆向进行,一氧化碳转化率减小,故B错误;
C、增大H2O 的浓度,平衡向正反应方向移动,CO的转化率升高,故C正确;
D、催化剂对化学平衡没有影响,一氧化碳转化率不变,故D错误;
故选C.
| ||
B、反应是放热反应,升高温度平衡向吸热方向移动,平衡逆向进行,一氧化碳转化率减小,故B错误;
C、增大H2O 的浓度,平衡向正反应方向移动,CO的转化率升高,故C正确;
D、催化剂对化学平衡没有影响,一氧化碳转化率不变,故D错误;
故选C.
点评:本题考查了化学平衡影响因素分析判断,掌握移动原理和反应特征是解题关键,题目较简单.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂HIn(红色溶液)?H+(溶液)+In-(黄色溶液)
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
浓度为0.02mol?L-1的下列各溶液:
①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水,
⑦AlCl3溶液
其中能使指示剂显红色的是( )
| A、②⑤⑥ | B、①④⑤ |
| C、①④⑦ | D、①④⑤⑦ |
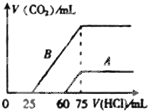 向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )
向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )| A、曲线A表明M中的溶质为NaOH、Na2CO3 |
| B、曲线B表明M中NaHCO3与Na2CO3的物质的量之比为1:2 |
| C、原NaOH溶液的物质的量浓度为0.75mol/L |
| D、由A.B可知,两次实验通入的CO2的体积比3:10 |
下列事实不能说明一元酸HA是弱酸的是( )
| A、中和一定的NaOH溶液,需消耗与NaOH等物质的量的HA |
| B、将pH=4的HA溶液稀释10倍,溶液pH小于5 |
| C、将pH=2的HA溶液与pH=12的NaOH溶液等体积混合后,溶液呈酸性 |
| D、将0.1mol/L的HA溶液与0.1 mol/L的NaOH溶液等体积混合后,溶液呈碱性 |
下列关于卤素及其化合物的叙述正确的是( )
| A、HF水溶液可存放在玻璃试剂瓶中 |
| B、Br2可从KCl溶液中置换出氯 |
| C、F、Cl、Br、I的非金属性依次减弱 |
| D、HF、HCl、HBr、HI的稳定性依次增强 |
有一处于平衡状态的反应:X(s)+3Y(g)?3Z(g),△H<0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①加入X②低温③高压④低压⑤加催化剂⑥分离出Z.
①加入X②低温③高压④低压⑤加催化剂⑥分离出Z.
| A、①③⑤ | B、②③⑤ |
| C、②⑥ | D、②④⑥ |
一定条件下,向一带活塞的密闭容器中充入1molN2和3molH2,发生下列反应:N2(g)+3H2(g)?2NH3(g),反应达到平衡后,改变下述条件,达到平衡后NH3的物质的量浓度不改变的是( )
| A、保持温度和容器压强不变,充入1molNH3(g) |
| B、保持温度和容器体积不变,充入1molNH3(g) |
| C、保持温度和容器体积不变,充入1molN2(g) |
| D、保持温度和容器体积不变,充入1molAr(g) |
