题目内容
18.可逆反应:I2(g)+H2(g)?2HI(g)在一定条件下已达到化学平衡状态.由于改变一个条件,达到新平衡时,可能引起下列变化,这些变化中能说明平衡一定向正反应方向移动的是( )①I2(g)浓度减小 ②混合气体颜色加深 ③I2(g)转化率增大
④HI(g)的含量增大 ⑤正反应速率增大.
| A. | ①② | B. | ③ | C. | ②③④ | D. | ③⑤ |
分析 平衡一定向正反应方向移动,可增大反应物的浓度、减小生成物的浓度等,据此分析.
解答 解:①I2(g)的浓度减小,平衡向逆反应方向移动,故①错误;
②混合气体的颜色变浅,可能是增大体积,平衡不移动,故②错误;
③I2(g)的转化率增大,平衡向正反应方向移动,故③正确;
④HI(g)的百分含量增大,可能是增大了HI的浓度,平衡向逆反应方向移动,故④错误;
⑤正反应速率增大,平衡可能不移动,如加催化剂,速率增大,平衡不移动,故⑤错误;
故选B.
点评 本题考查影响化学平衡的因素,题目难度不大,注意把握从平衡移动的角度判断反应的方向,试题有利于培养学生的分析、理解能力及对基础知识的应用能力.

练习册系列答案
相关题目
9.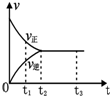 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
3.从海水中提取部分物质的过程如图所示,下列有关说法错误的是( )
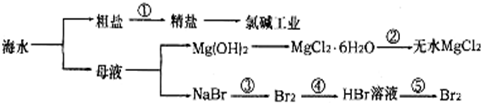

| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
10.下列说法中,不正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| B. | 破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 热化学方程式中反应热数值的大小与化学方程式的计量数成比例 |
7.低温脱硝技术可用于处理废气中的氮氧化物发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$?_{催化剂}^{180℃}$
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加 NH3 的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗 NO 和 N2 的物质的量比为 1:2 时,反应达到平衡 |
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
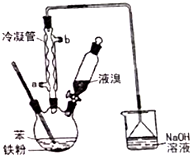 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去) +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
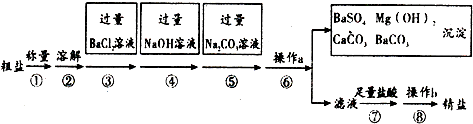
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体. 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下: