题目内容
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1 mol羟基与1 mol氢氧根离子所含的电子数均为9NA | |
| B. | 常温下,44 g N2O和CO2组成的混合气体,所含原子数为3NA | |
| C. | 0.1 mol/L的NaClO溶液,含有的阴离子数为0.1NA | |
| D. | 常温下,将 1 mol Fe投入过量浓硝酸中,转移的电子数为3NA |
分析 A、-OH中含9个电子,氢氧根中含10个电子;
B、N2O和CO2的摩尔质量均为44g/mol,且均含3个原子;
C、溶液体积不明确;
D、铁在浓硝酸中钝化.
解答 解:A、-OH中含9个电子,氢氧根中含10个电子,故1mol-OH中含9NA个电子,而1mol氢氧根中含10NA个电子,故A错误;
B、N2O和CO2的摩尔质量均为44g/mol,故44g混合物的物质的量为1mol,且均含3个原子,故1mol混合物中含3NA个原子,故B正确;
C、溶液体积不明确,故溶液中的阴离子的个数无法计算,故C错误;
D、铁在浓硝酸中钝化,故转移的电子数小于3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.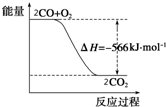 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |
16.常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)?2C(g)+D(g)△H=-a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |
3.将一定量的固体Ag2SO4置于容积不变的容器中(装有少量V2O5),在某温度下发生反应:
Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g)反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中正确的是( )
Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g)反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中正确的是( )
| A. | 容器里气体的密度为40 g/L | |
| B. | SO3的分解率为30% | |
| C. | 在这10 min内的平均速率为v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化学反应速率:v(Ag2SO4)=v(SO3) |
20.在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$,该反应为放热反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC;
A.容器中压强不变 B.混合气体中c(CO)不变 C.v逆(H2)=v正(H2O) D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态否(是或否)处于平衡状态?若不是,反应向哪个方向进行?向逆反应方向.(选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为83.3%(或83%,或5/6).
CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$,该反应为放热反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC;
A.容器中压强不变 B.混合气体中c(CO)不变 C.v逆(H2)=v正(H2O) D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态否(是或否)处于平衡状态?若不是,反应向哪个方向进行?向逆反应方向.(选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为83.3%(或83%,或5/6).
17.维生素C又称“抗坏血酸”,能将人体不易吸收的Fe3+转化为Fe2+,这说明维C是( )
| A. | 电解质 | B. | 氧化剂 | C. | 还原剂 | D. | 胶体 |
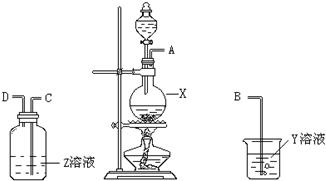 某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.