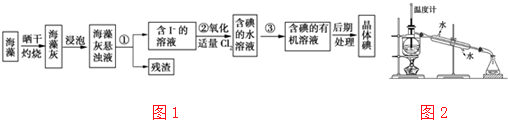
题目内容
13. 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:①在烧杯中加入20.0ml,1mol•L-1硫酸并加入a g草酸微热,再慢慢分次加入a g MnO2,盖上表面皿,使其充分反应.
②煮沸溶液并趁热过滤.
③往热滤液中加入b g硫酸铵,待硫酸铵全部溶解后,在冰水浴中冷却,30分钟后过滤,并用少量乙醇溶液洗涤两次,用滤纸吸干或放在表面皿上干燥.
④称得产品质量为 c g.
根据以上信息,回答下列问题:
(1)配制100mL 1mol•L-1硫酸溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外,还需要100 mL容量瓶、胶头滴管.
(2)MnO2与草酸的硫酸溶液反应的化学方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O.
(3)用乙醇洗涤的目的是减少产品损失,同时便于干燥.
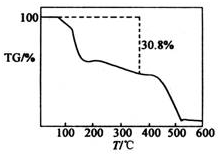
(4)为确定其化学式,现对产品在氮气中进行热重分析,已知在371℃下结晶水会全部失去.其TG曲线如图所示.(TG=$\frac{固体样品的剩余质量}{固体样品的起始质量}$×100%)则(NH4)2SO4•MnSO4•nH2O中的n=7(填数字,取整数).
分析 ①在烧杯中加入20.0ml,1mol•L-1硫酸并加入a g草酸微热,再慢慢分次加入a g MnO2,盖上表面皿,使其充分反应.
②煮沸溶液并趁热过滤.
③往热滤液中加入b g硫酸铵,待硫酸铵全部溶解后,在冰水浴中冷却,30分钟后过滤,并用少量乙醇溶液洗涤两次,用滤纸吸干或放在表面皿上干燥.
④称得产品质量为 c g.
(1)根据配制溶液的基本操作可知,配制100mL 1mol•L-1硫酸溶液时,需要的玻璃仪器为烧杯、玻璃棒、100 mL容量瓶、胶头滴管;
(2)MnO2被草酸的硫酸溶液还原为锰离子,根据电子得失守恒和元素守恒书写反应的化学方程式;
(3)乙醇易挥发,且硫酸锰铵在乙醇中的溶解度小;
(4)根据$\frac{M[(N{H}_{4})_{2}S{O}_{4}•MnS{O}_{4}]}{M[(N{H}_{4})_{2}S{O}_{4}•MnS{O}_{4}•n{H}_{2}O]}$×100%=1-30.8%可计算n的值;
解答 解:(1)根据配制溶液的基本操作可知,配制100mL 1mol•L-1硫酸溶液时,需要的玻璃仪器为烧杯、玻璃棒、100 mL容量瓶、胶头滴管,
故答案为:100 mL容量瓶、胶头滴管;
(2)MnO2被草酸的硫酸溶液还原为锰离子,根据电子得失守恒和元素守恒可知反应的化学方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;
(3)乙醇易挥发,且硫酸锰铵在乙醇中的溶解度小,所以用乙醇洗涤的目的是减少产品损失,同时便于干燥,
故答案为:减少产品损失,同时便于干燥;
(4)根据$\frac{M[(N{H}_{4})_{2}S{O}_{4}•MnS{O}_{4}]}{M[(N{H}_{4})_{2}S{O}_{4}•MnS{O}_{4}•n{H}_{2}O]}$×100%=1-30.8%可得$\frac{283}{283+18x}$×100%=1-30.8%,所以n=7,
故答案为:7.
点评 本题考查了硫酸锰铵晶体的制取,涉及的知识点比较多,可以根据所学知识,合理分析得出正确结论,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
 已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;
已知:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol;Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO(g)与Na2O2(s)反应放出509kJ热量时,消耗的CO是28g | |
| B. | 如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO的燃烧热为-566 kJ/mol |
| 实验I | 实验II | 实验III | |
| 反应温度/℃ | 800 | 800 | 850 |
| c( A)起始/mol•L-1 | 1 | 2 | 1 |
| c( A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 化学平衡常数实验III的小于实验I的 | |
| B. | 实验放出的热量关系为b>2a | |
| C. | 实验III 在30min达到平衡,用A表示此段时间的平均反应速率v (A)为0.005mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应已达平衡 |
(1)小组同学对NO2 与Na2O2 的反应提出以下假设.
假设一:生成NaNO3,反应的化学方程式为2NO2+Na2O2═2NaNO3
假设二:生成NaNO2,反应的化学方程式为2NO2+Na2O2═2NaNO2+O2.
(2)小组同学在通风橱中制备并收集干燥的NO2 后进行如下实验:
| 序号 | 操作步骤 | 现象 |
| 实验1 | 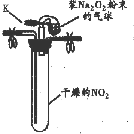 ①按如图组装仪器,打开K,将气球中的Na2O2粉末导入试管中,振荡,充分反应 | 试管内红棕色消失,气球变瘪 |
| ②试管冷却后,打开胶塞,加入5mL蒸馏水 | 未见红棕色气体,试管底部固体全部溶解得澄清溶液 |
②有同学根据实验1 中“气球变瘪”的现象推断假设一成立,你认为是否合理并简述理由:不能根据“气球变瘪”的现象推断假设一成立,理由是:根据方程式可以发现无论是按假设一还是假设二发生反应,体系的压强都要减小,都能观察到“气球变瘪”的现象.
(3)小组同学进一步对产物进行检验
查阅资料:
i.Na2O2 与水反应会生成H2O2;
ii.NO2-具有还原性,可用KMnO4 酸性溶液进行检验;
iii.含NO3-的溶液遇 FeSO4和浓硫酸生成棕色物质[Fe(NO)]2-
进行实验:
| 序号 | 操作步骤 | 现象 |
| 实验2 | 取实验1所得清液, 向其中加入少量MnO2粉末,待不再产生气泡后,静置后取上层清液,再调节此溶液pH至7左右 | / |
| 实验3 | 取实验2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序号 | 操作步骤 | 现象 |
| 实验4 | ①向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 滴入NaNO3溶液,无明显变化,加入浓硫酸后,溶液变棕色 |
| ②向试管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振荡,再向试管中加入0.5mL98%的浓硫酸 | 加入NaNO2溶液,立即变棕色,加入浓硫酸后,溶液无明显变化 | |
| ③向试管中加入2mL新制FeSO4溶液,再加入10滴实验2后的清液,振荡,再加0.5mL98%的浓硫酸 | 滴加实验2得到的清液后,溶液立即变浅棕色,加入浓硫酸后,溶液变深棕色 |
②根据实验3 的现象可得出结论“产物含”NO2-,该实验的现象是KMnO4溶液褪色.
③实验4 中进行步骤②的目的是通过和实验4步骤①进行对比,排除NO2-的存在对NO3-检验的干扰.
(4)该小组同学由以上全部实验可得出结论:Na2O2和NO2反应既能生成NaNO3也能生成NaNO2(或“假设一和假设二都成立”,或“Na2O2和NO2反应的产物中既含NO2-又含NO3-”).
Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g)反应经过10min达到平衡,测得c(SO3)=0.4mol/L、c(SO2)=0.1mol/L,则下列叙述中正确的是( )
| A. | 容器里气体的密度为40 g/L | |
| B. | SO3的分解率为30% | |
| C. | 在这10 min内的平均速率为v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化学反应速率:v(Ag2SO4)=v(SO3) |