题目内容
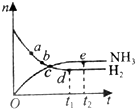
9.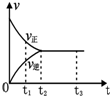 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
分析 A.t1时,正反应速率减小,逆反应速率增大;
B.t2时,达平衡状态,反应到达限度;
C.t2-t3时间段,各物质的浓度不再发生变化,反应达到平衡状态,v正═v逆>0;
D.t3以后,达到平衡状态,各物质的浓度保持不变.
解答 解:A.该反应是可逆反应,t1时,正反应速率减小,逆反应速率增大,正逆反应同时进行,故A错误;
B.t2时,达平衡状态,正逆反应速率相等,反应到达限度,反应物的转化率最大,反应体系中NH3的浓度达到最大值,故B正确;
C.t2-t3时间段,各物质的浓度不再发生变化,反应达到平衡状态,v正═v逆>0,反应没有停止,故C错误;
D.t3以后,达到平衡状态,各物质的浓度保持不变,但各物质的浓度不一定相等,故D错误.
故选:B.
点评 本题考查了反应速率(v)与时间(t)的关系曲线分析,明确图象中曲线变化趋势含义是解本题关键,知道化学平衡状态判断方法,题目难度不大.

练习册系列答案
相关题目
14.下列叙述正确的选项是( )
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为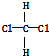 和 和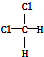 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
1.对于可逆反应4NH3+5O2?4NO+6H2O(g),下列叙述正确的是( )
| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
19.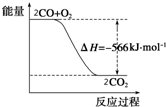 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
 已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1Na2O2(s)+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ•mol-1
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为566 kJ•mol-1 | |
| B. | 如图可表示由CO生成CO2的反应过程中能量变化的过程 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2 mol |