题目内容
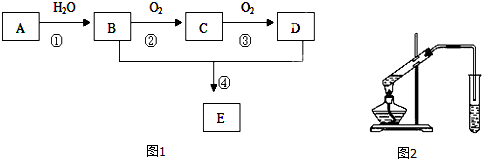
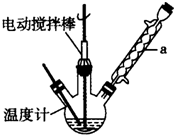
6. 溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)
溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如图.(夹持仪器已略去)请回答以下问题.
(1)制取溴苯的化学方程式是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.
+HBr,反应过程中烧瓶内有白雾产生,是因为生成HBr了气体.(2)该实验中用到冷凝管,由此猜想生成溴苯的反应属于放热反应(填“放热”或“吸热”);使用冷凝管时,进水口应是a(填“a”或“b”);烧杯中NaOH溶液的作用是吸收HBr和未反应的Br2,防止污染大气(答一条即可).
(3)该实验中将液溴全部加入苯中,充分反应后,为提纯溴苯,进行以下操作:
①继续向烧瓶中加入少量水,然后过滤除去未反应的铁屑,过滤时必须用到的玻璃仪器是烧杯、玻璃棒、漏斗.
②滤液在经一系列处理,最终得到的粗溴苯中仍含有少量苯,要进一步提纯溴苯,可进行的操作是C(填序号)
| 苯 | 溴苯 | |
| 沸点/℃ | 80 | 156 |
| 水中溶解度 | 微溶 | 微溶 |
分析 (1)苯与液溴反应生成 和HBr,HBr与水蒸气结合呈白雾;
和HBr,HBr与水蒸气结合呈白雾;
(2)冷凝管的作用为冷凝回流,水应该为下进上出,说明有物质挥发,则由此说猜想生成溴苯的反应属于放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气;
(3)①过滤时必须用到的玻璃仪器是烧杯、玻璃棒和漏斗;
②由分离操作可知,分离出的粗溴苯中含有未反应的苯,分离互溶的液体,根据沸点不同,利用蒸馏的方法进行分离.
解答 解:(1)苯与液溴反应生成 和HBr,反应方程式为
和HBr,反应方程式为 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,HBr与水蒸气结合呈白雾,故答案为:
+HBr,HBr与水蒸气结合呈白雾,故答案为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr;HBr;
+HBr;HBr;
(2)冷凝管的作用为冷凝回流,水应该为下进上出即进水口应为a,说明有物质挥发,则由此说猜想生成溴苯的反应属于放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,作用为吸收HBr和未反应的Br2,防止污染大气;
故答案为:放热;a;吸收HBr和未反应的Br2,防止污染大气;
(3)①过滤时必须用到的玻璃仪器是烧杯、玻璃棒和漏斗,故答案为:漏斗;
②反应后得到的溴苯中溶有少量未反应的苯.利用沸点不同,苯的沸点小,被蒸馏出,溴苯留在母液中,所以采取蒸馏的方法分离溴苯与苯;
故选:C.
点评 本题主要考查了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,题目难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
7.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②CuO③CO④Cu2S⑤Na2O2⑥MgCl2⑦A1Cl3⑧NaHCO3⑨FeCl3⑩Fe(OH)3.
①FeCl2 ②CuO③CO④Cu2S⑤Na2O2⑥MgCl2⑦A1Cl3⑧NaHCO3⑨FeCl3⑩Fe(OH)3.
| A. | 只有①②③④⑦ | B. | 只有⑤⑥⑧⑨⑩ | C. | 只有①③⑤⑦⑨ | D. | 全部 |
14.下列叙述正确的选项是( )
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为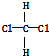 和 和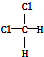 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
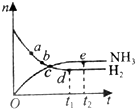
1.对于可逆反应4NH3+5O2?4NO+6H2O(g),下列叙述正确的是( )
| A. | 若单位时间生成xmolNO的同时,消耗1.5xmolH2O,则反应达到平衡状态 | |
| B. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为4:5:4:6 | |
| C. | 达到平衡状态时,若增加容器体积,则反应速率增大 | |
| D. | 达到平衡时,5v正(O2)=4v逆(NO) |
11. 甲苯(
甲苯(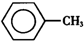 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(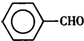 )、苯甲酸(
)、苯甲酸(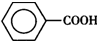 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过 氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.【苯甲酸相对分子质量:122.0】
 甲苯(
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过 氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.【苯甲酸相对分子质量:122.0】
16.常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)?2C(g)+D(g)△H=-a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
| A. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| B. | 该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 使用催化剂或缩小容器体积,该平衡均不会移动 |