题目内容
同温同压下,A容器中氯化氢与B容器中氨气所含原子数相等,两容器体积之比为( )
| A、1:4 | B、2:1 |
| C、1:2 | D、4:1 |
考点:物质的量的相关计算
专题:计算题
分析:容器A中HCl与容器B中NH3所含原子数相等,则分子数之比为2;1,结合N=nNA可知,HCl与NH3的物质的量之比为2:1,同温同压下,气体的Vm相等,体积之比等于物质的量之比.
解答:
解:容器A中HCl与容器B中NH3所含原子数相等,则分子数之比为2;1,结合N=nNA可知,HCl与NH3的物质的量之比为2:1,同温同压下,气体的Vm相等,体积之比等于物质的量之比,故两容器体积之比=2:1,故选B.
点评:本题考查阿伏伽德罗定律及其推论,题目难度不大,注意同温同压下,气体的Vm相等,关键是根据物质的分子构成确定二者物质的量关系.

练习册系列答案
相关题目
按图1的装置进行试验,若图2中X轴表示阴极的电子的量,则Y轴可能表示为( )


| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
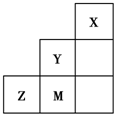 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列说法中,正确的是( )
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
下列关于稀有气体的叙述正确的是( )
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
 图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )
图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )| A、电池的能量转化率可达100% |
| B、铝罐是电池的负极 |
| C、碳棒应与玩具电机的负极相连 |
| D、电池工作一段时间后碳棒和炭粒的质量会减轻 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍,D与A为同主族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
 通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力.按要求回答下列问题.