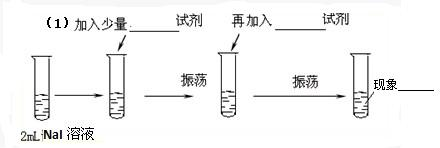
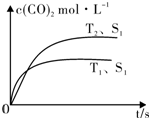
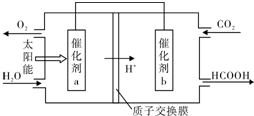
题目内容
现有0.1mol/LNaHA溶液pH=1:
(1)此溶液和等浓度等体积氨水混合反应的离子方程式为:
混合溶液中离子浓度由大到小的顺序为:
(2)25℃时此溶液和某浓度氨水pH之和为14,二者等体积混合后溶液中离子浓度由大到小的顺序为:
(3)氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
①做此实验滴定终点的现象是:
②下列操作会导致测定结果偏高的是
A.滴定前读数准确滴定后俯视读数
B.滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分无气泡
C.滴定前锥形瓶未干燥
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.未用标准浓度的酸性KMnO4溶液润洗滴定管.
(1)此溶液和等浓度等体积氨水混合反应的离子方程式为:
混合溶液中离子浓度由大到小的顺序为:
(2)25℃时此溶液和某浓度氨水pH之和为14,二者等体积混合后溶液中离子浓度由大到小的顺序为:
(3)氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
①做此实验滴定终点的现象是:
②下列操作会导致测定结果偏高的是
A.滴定前读数准确滴定后俯视读数
B.滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分无气泡
C.滴定前锥形瓶未干燥
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.未用标准浓度的酸性KMnO4溶液润洗滴定管.
考点:离子方程式的书写,离子浓度大小的比较,配制一定物质的量浓度的溶液
专题:实验题,离子反应专题
分析:(1)0.1mol/LNaHA溶液pH=1说明NaHA在水溶液中完全电离出钠离子、氢离子和A-离子,氢离子与一水合氨反应生成氨根离子和水;
各取1L0.1mol/LNaHA溶液pH=1和等浓度氨水混合反应生成0.5molNa2A,0.5mol(NH4)2A,A2-离子为强酸根离子,氨根离子为弱碱阳离子水解,据此解答;
(2)25℃时此溶液和某浓度氨水pH之和为14,可知该氨水的物质的量浓度远远大于0.1mol/L,反应后溶液中含溶质Na2A,NH4)2A,NH3?H2O,据此解答;
(3)高锰酸钾是强氧化性的溶液,高锰酸钾溶液滴入NaHSO3溶液中,发生氧化还原反应,高锰酸钾褪色,当反应到达终点利用高锰酸钾溶液滴入最后一滴溶液变为紫色,半分钟不变化则可证明反应完全; 根据c(待)=
判断错误操作对相关物理量的影响.
各取1L0.1mol/LNaHA溶液pH=1和等浓度氨水混合反应生成0.5molNa2A,0.5mol(NH4)2A,A2-离子为强酸根离子,氨根离子为弱碱阳离子水解,据此解答;
(2)25℃时此溶液和某浓度氨水pH之和为14,可知该氨水的物质的量浓度远远大于0.1mol/L,反应后溶液中含溶质Na2A,NH4)2A,NH3?H2O,据此解答;
(3)高锰酸钾是强氧化性的溶液,高锰酸钾溶液滴入NaHSO3溶液中,发生氧化还原反应,高锰酸钾褪色,当反应到达终点利用高锰酸钾溶液滴入最后一滴溶液变为紫色,半分钟不变化则可证明反应完全; 根据c(待)=
| C(标)V(标) |
| V(待) |
解答:
解:(1)有题意可知:NaHA=Na++H++A-,则NaHA溶液与氨水反应的离子方程式:H++NH3.H2O=NH4++H2O,
二者反应得到的混合溶液中含有0.5molNa2A,0.5mol(NH4)2A,如果各种离子都不水解,则应该有0.1molNa+,0.1molNH4+,0.1molA2-,而氨根离子是弱碱阳离子一小部分水解生成一水合氨和氢离子,所以离子浓度小于0.5mol,溶液中氢离子浓度大于氢氧根离子浓度,所以离子浓度大小顺序为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
故答案为:H++NH3.H2O=NH4++H2O;c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
(2)25℃时此溶液和某浓度氨水pH之和为14,可知该氨水的物质的量浓度远远大于0.1mol/L,各取1L两种溶液,反应后溶液中所含溶质为:0.5molNa2A,0.5mol(NH4)2A,大量的NH3.H2O,一水合氨电离产生氨根离子和氢氧根离子,所以c(NH4+)>0.5mol,c(Na+)=c(A2-)=0.1mol,c(OH-)>c(H+),所以离子浓度大小顺序为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
(3)高锰酸钾与亚硫酸氢钠反应而褪色,当恰好把亚硫酸氢钠反应完全,再滴入一滴高锰酸钾,紫色持续半分钟不褪色,可证明反应达到终点;
A.滴定前读数准确滴定后俯视读数造成V(标)偏小,根据c(待)=
可知c(待)偏小,故A错误;
B.滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分无气泡,造成V(标)偏大,根据c(待)=
可知c(待)偏大,故B正确;
C.滴定前锥形瓶未干燥,对V(标)没有影响,c(待)不变,故C错误;
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,导致V(标)偏大,根据c(待)=
可知c(待)偏大,故D正确;
E.未用标准浓度的酸性KMnO4溶液润洗滴定管,导致V(标)偏大,根据c(待)=
可知c(待)偏大,故E正确;
故答案为:溶液由无色变成紫色;BDE.
二者反应得到的混合溶液中含有0.5molNa2A,0.5mol(NH4)2A,如果各种离子都不水解,则应该有0.1molNa+,0.1molNH4+,0.1molA2-,而氨根离子是弱碱阳离子一小部分水解生成一水合氨和氢离子,所以离子浓度小于0.5mol,溶液中氢离子浓度大于氢氧根离子浓度,所以离子浓度大小顺序为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
故答案为:H++NH3.H2O=NH4++H2O;c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
(2)25℃时此溶液和某浓度氨水pH之和为14,可知该氨水的物质的量浓度远远大于0.1mol/L,各取1L两种溶液,反应后溶液中所含溶质为:0.5molNa2A,0.5mol(NH4)2A,大量的NH3.H2O,一水合氨电离产生氨根离子和氢氧根离子,所以c(NH4+)>0.5mol,c(Na+)=c(A2-)=0.1mol,c(OH-)>c(H+),所以离子浓度大小顺序为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Na+)=c(A2-)>c(NH4+)>c(H+)>c(OH-);
(3)高锰酸钾与亚硫酸氢钠反应而褪色,当恰好把亚硫酸氢钠反应完全,再滴入一滴高锰酸钾,紫色持续半分钟不褪色,可证明反应达到终点;
A.滴定前读数准确滴定后俯视读数造成V(标)偏小,根据c(待)=
| C(标)V(标) |
| V(待) |
B.滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分无气泡,造成V(标)偏大,根据c(待)=
| C(标)V(标) |
| V(待) |
C.滴定前锥形瓶未干燥,对V(标)没有影响,c(待)不变,故C错误;
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,导致V(标)偏大,根据c(待)=
| C(标)V(标) |
| V(待) |
E.未用标准浓度的酸性KMnO4溶液润洗滴定管,导致V(标)偏大,根据c(待)=
| C(标)V(标) |
| V(待) |
故答案为:溶液由无色变成紫色;BDE.
点评:本题考查了离子反应方程式的书写,离子浓度大小的比较,中和滴定实验操作和误差分析,题目难度中等,该题综合性较强,所涉及的知识点都很重要,易错点为离子浓度大小,注意判断混合溶液中离子浓度大小,应先确定溶液中所含溶质有哪些,在考虑弱电解质的电离和离子的水解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述正确的是( )
A、用石墨电极电解MgCl2饱和溶液的总反应为:Mg2++2Cl-
| ||||
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA | ||||
| C、氢氧酸性燃料电池放电时,正极反应为:O2+4e-+4H+=2H2O | ||||
| D、铅蓄电池在放电过程中,负极质量增加,正极质量增加 |
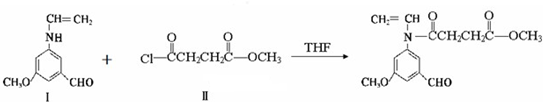
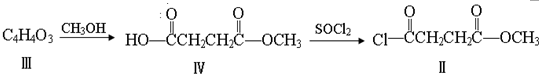
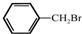 与
与 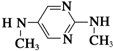 在一定条件下按物质的量2:1的比例发生类似
在一定条件下按物质的量2:1的比例发生类似 系统命名为
系统命名为 的炔烃的结构简式
的炔烃的结构简式 系统命名为
系统命名为 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.