题目内容
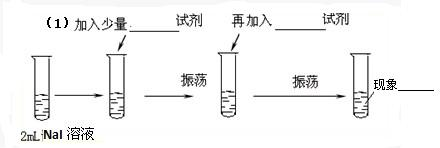
为测定Cl2、I2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、碘水、NaCl溶液、NaI溶液、酒精、四氯化碳)实验步骤如图:
(1)
(2)该实验可以证明Cl2的氧化性 (填“>”、“<”)I2的氧化性,此反应的离子方程式为 .
(1)

(2)该实验可以证明Cl2的氧化性
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:根据同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性来设计实验,要想比较氯气的氧化性大于碘的氧化性,只要使氯气和碘的盐溶液混合观察是否有碘单质生成,如果有碘单质生成就说明氯气的氧化性大于碘单质,否则不能证明.
解答:
解:(1)要想比较氯气和碘的氧化性大小,做如下实验:
少量碘化钠反应→加适量氯水(振荡,溶液由黄绿色变成紫色)→加入四氯化碳(振荡)→现象(溶液分层,下层紫红色,上层无色)→说明氯气和碘离子反应,能证明氯气的氧化性大于碘.
故答案为:适量氯水;四氯化碳;溶液分层,下层紫红色,上层无色;
(2)通过以上实验知,氯气的氧化性大于溴,离子方程式为:Cl2+2Br-=Br2+2Cl-.
故答案为:>;Cl2+2Br-=Br2+2Cl-.
少量碘化钠反应→加适量氯水(振荡,溶液由黄绿色变成紫色)→加入四氯化碳(振荡)→现象(溶液分层,下层紫红色,上层无色)→说明氯气和碘离子反应,能证明氯气的氧化性大于碘.
故答案为:适量氯水;四氯化碳;溶液分层,下层紫红色,上层无色;
(2)通过以上实验知,氯气的氧化性大于溴,离子方程式为:Cl2+2Br-=Br2+2Cl-.
故答案为:>;Cl2+2Br-=Br2+2Cl-.
点评:本题考查了探究卤素单质间的置换反应,明确实验目的、正确选取实验药品、能根据实验现象得出结论是解本题的关键,对学生来说难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

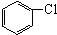 与
与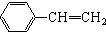 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为