题目内容
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO2(g)+N2(g)
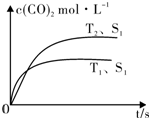
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的平衡常数表达式为 .
②该反应的△H 0(选填“>”、“<”).
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 .
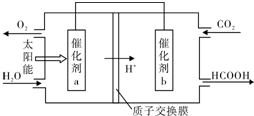
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.下图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式 .催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a).
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:

①该反应的平衡常数表达式为
②该反应的△H
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
2NO2(g)?N2O4(g)△H=-56.9kJ?mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.下图是通过光电转化原理以廉价原料制备新产品的示意图.写出上述光电转化过程的化学反应方程式

考点:物质的量或浓度随时间的变化曲线,常见的能量转化形式,热化学方程式,原电池和电解池的工作原理
专题:基本概念与基本理论
分析:(1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
②先比较T1和T2,结合图象中c(CO2)的大小获得热效应;
③催化剂的表面积S1>S2,S2反应速率比S1小,催化剂不影响化学平衡的移动;
(2)①利用盖斯定律写出化学方程式;
②根据体系中进入的物质和得到的物质获得反应物和生成物,利用氧化还原方程式的配平写出化学方程式;根据溶液中阳离子的移动判断电子的流向.
②先比较T1和T2,结合图象中c(CO2)的大小获得热效应;
③催化剂的表面积S1>S2,S2反应速率比S1小,催化剂不影响化学平衡的移动;
(2)①利用盖斯定律写出化学方程式;
②根据体系中进入的物质和得到的物质获得反应物和生成物,利用氧化还原方程式的配平写出化学方程式;根据溶液中阳离子的移动判断电子的流向.
解答:
解:(1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,故答案为:K=
;
②图象中T1先达平衡,即T1>T2,由于T1中c(CO2)较小,即温度升高,化学平衡向逆反应方向移动,为放热反应,故答案为:<;
③催化剂的表面积S1>S2,S2反应速率比S1小,即达到平衡所需时间长,由于催化剂不影响化学平衡的移动,达平衡状态时,与T2、S1条件下相同,故答案为:
 ;
;
(2)①利用第一个反应减去第二个反应就可以得到热化学方程式为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1 kJ?mol-1,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1 kJ?mol-1;
②体系中进入的物质为:CO2和H2O,则反应物为:CO2和H2O,得到的物质为:HCOOH和O2,生成物为:HCOOH和O2,利用氧化还原方程式的配平写出化学方程式为:2CO2+2H2O
2HCOOH+O2;体系中氢离子从 a→b,则电流的方向为:b→a,电子的流向为:a→b,故答案为:
2HCOOH+O2;a→b.
| c2(CO2)?c(N2) |
| c2(NO)?c2(CO) |
②图象中T1先达平衡,即T1>T2,由于T1中c(CO2)较小,即温度升高,化学平衡向逆反应方向移动,为放热反应,故答案为:<;
③催化剂的表面积S1>S2,S2反应速率比S1小,即达到平衡所需时间长,由于催化剂不影响化学平衡的移动,达平衡状态时,与T2、S1条件下相同,故答案为:
 ;
;(2)①利用第一个反应减去第二个反应就可以得到热化学方程式为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1 kJ?mol-1,
故答案为:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g)△H=-810.1 kJ?mol-1;
②体系中进入的物质为:CO2和H2O,则反应物为:CO2和H2O,得到的物质为:HCOOH和O2,生成物为:HCOOH和O2,利用氧化还原方程式的配平写出化学方程式为:2CO2+2H2O
| ||
| ||
点评:本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、热化学方程式书写、原电池、电离平衡常数与水解平衡常数等,题目综合性较大,难度中等,是对知识的综合利用、注意基础知识的理解掌握.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的量浓度、反应速率分别随时间的变化如图所示: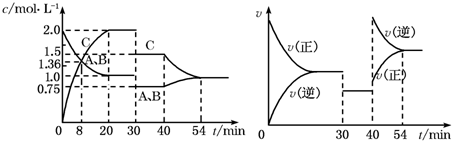
下列说法中正确的是( )

下列说法中正确的是( )
| A、30min~40min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为放热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、8min前A的平均反应速率为0.08mol?L-1?min-1 |
下列说法正确的是( )
| A、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 |
| B、用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 |
| C、邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
| D、向某溶液中加入茚三铜试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质 |
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位.