题目内容
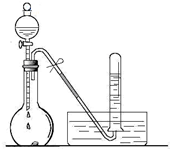 某校化学实验小组同学进行有关NO2气体的系列实验.
某校化学实验小组同学进行有关NO2气体的系列实验.(1)如图所示,烧瓶中放有a g铜片,打开分液漏斗的旋塞,加入过量浓硝酸,写出反应的离子方程式
用水收集气体后,试管中气体的颜色是
(2)将烧瓶浸入冰水中,烧瓶内气体颜色
(3)若测得烧瓶中共产生气体2.24L(标准状况),反应后烧瓶溶液中的H+为1mol,则滴入烧瓶的硝酸的物质的量为
考点:氮的氧化物的性质及其对环境的影响,实验装置综合
专题:氮族元素
分析:(1)金属铜可以和浓硝酸之间反应生成硝酸铜、二氧化氮以及水,据此书写离子方程式,二氧化氮和水之间反应生成硝酸和一氧化氮;
(2)二氧化氮和四氧化二氮之间存在平衡转化2NO2?N2O4;
(3)在金属铜和硝酸的反应中,硝酸既是氧化剂又显示酸性根据气体的量确定显示氧化性硝酸的量,根据生成硝酸铜确定显示酸性的硝酸的量.
(2)二氧化氮和四氧化二氮之间存在平衡转化2NO2?N2O4;
(3)在金属铜和硝酸的反应中,硝酸既是氧化剂又显示酸性根据气体的量确定显示氧化性硝酸的量,根据生成硝酸铜确定显示酸性的硝酸的量.
解答:
解:(1)金属铜可以和浓硝酸之间反应生成硝酸铜、二氧化氮以及水,即Cu+4H++NO3-=Cu2++NO2↑+4H2O,如果用水收集,则二氧化氮和水之间反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,一氧化氮是无色气体,
故答案为:Cu+4H++NO3-=Cu2++NO2↑+4H2O;无色;3NO2+H2O=2HNO3+NO;
(2)二氧化氮和四氧化二氮之间存在平衡转化:2NO2?N2O4,二氧化氮是红棕色物质,四氧化二氮是无色的,所以颜色会变浅,故答案为:变浅;2NO2?N2O4;
(3)若测得烧瓶中共产生气体2.24L即0.1mol(标准状况),显示氧化性的硝酸是0.1mol,反应后烧瓶溶液中的H+为1mol,则剩余的硝酸是1mol,铜成为硝酸铜,显示酸性的硝酸是
×2=
mol,所以加入硝酸的物质的量是(
+1.1)mol,
故答案为:
+1.1.
故答案为:Cu+4H++NO3-=Cu2++NO2↑+4H2O;无色;3NO2+H2O=2HNO3+NO;
(2)二氧化氮和四氧化二氮之间存在平衡转化:2NO2?N2O4,二氧化氮是红棕色物质,四氧化二氮是无色的,所以颜色会变浅,故答案为:变浅;2NO2?N2O4;
(3)若测得烧瓶中共产生气体2.24L即0.1mol(标准状况),显示氧化性的硝酸是0.1mol,反应后烧瓶溶液中的H+为1mol,则剩余的硝酸是1mol,铜成为硝酸铜,显示酸性的硝酸是
| a |
| 64 |
| a |
| 32 |
| a |
| 32 |
故答案为:
| a |
| 32 |
点评:本题考查学生含氮化合物的性质,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
相关题目
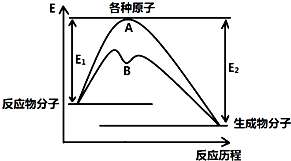 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题: