题目内容
下列叙述正确的是( )
A、用石墨电极电解MgCl2饱和溶液的总反应为:Mg2++2Cl-
| ||||
| B、精炼铜过程中阴极增重6.4g时,电路中转移电子数大于0.2NA | ||||
| C、氢氧酸性燃料电池放电时,正极反应为:O2+4e-+4H+=2H2O | ||||
| D、铅蓄电池在放电过程中,负极质量增加,正极质量增加 |
考点:电解原理,原电池和电解池的工作原理
专题:电化学专题
分析:A、电解过程中溶液中氯离子在阳极失电子生成氯气,溶液中氢离子在阴极电镀电子生成氢气,溶液中氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;
B、精炼铜,阴极是铜离子得到电子生成铜.阳极生成铜计算过程中电子转移;
C、氢氧燃料电池是酸性溶液,正极上氧气得到电子生成水;
D、铅蓄电池电极反应分析可知,正负极上生成的硫酸铅在电极上析出,电极质量增大.
B、精炼铜,阴极是铜离子得到电子生成铜.阳极生成铜计算过程中电子转移;
C、氢氧燃料电池是酸性溶液,正极上氧气得到电子生成水;
D、铅蓄电池电极反应分析可知,正负极上生成的硫酸铅在电极上析出,电极质量增大.
解答:
解:A、电解过程中溶液中氯离子在阳极失电子生成氯气,溶液中氢离子在阴极电镀电子生成氢气,溶液中氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀,反应的离子方程式为:2H2O+Mg2++2Cl-
Mg(OH)2↓+Cl2↑+H2↑,故A错误;
B、精炼铜,阴极是铜离子得到电子生成铜.阳极生成铜计算过程中电子转移,阴极增重6.4g时生成铜物质的量为0.1mol,Cu2++2e-=Cu,电路中转移电子数等于0.2NA,故B错误
C、氢氧燃料电池是酸性溶液,正极上氧气得到电子生成水,电极反应为:O2+4e-+4H+=2H2O,故C正确;
D、铅蓄电池放电时,铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为,Pb+SO42--2e-═PbSO4,正极上二氧化铅得电子和氢离子、硫酸根离子反应生成硫酸铅和水,电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,正负极上生成的硫酸铅在电极上析出,电极质量增大,故D正确;
故选CD.
| ||
B、精炼铜,阴极是铜离子得到电子生成铜.阳极生成铜计算过程中电子转移,阴极增重6.4g时生成铜物质的量为0.1mol,Cu2++2e-=Cu,电路中转移电子数等于0.2NA,故B错误
C、氢氧燃料电池是酸性溶液,正极上氧气得到电子生成水,电极反应为:O2+4e-+4H+=2H2O,故C正确;
D、铅蓄电池放电时,铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为,Pb+SO42--2e-═PbSO4,正极上二氧化铅得电子和氢离子、硫酸根离子反应生成硫酸铅和水,电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,正负极上生成的硫酸铅在电极上析出,电极质量增大,故D正确;
故选CD.
点评:本题考查了电解池、原电池原理的分析判断,电极反应特征分析是解题关键,题目难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
有9种物质:①甲烷 ②环己烷 ③环己烯 ④苯乙烯 ⑤聚乙烯 ⑥2-丁炔 ⑦苯 ⑧邻-二甲苯 ⑨Na2SO3溶液,其中既能使酸性KMnO4溶液褪色,又能因化学反应使溴水褪色的是( )
| A、③④⑥⑨ | B、③④⑥⑧ |
| C、③④⑤⑥⑨ | D、③④⑤⑥⑧ |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的量浓度、反应速率分别随时间的变化如图所示: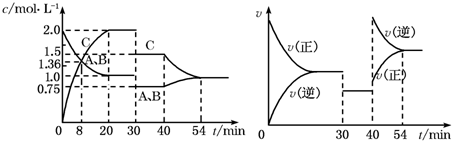
下列说法中正确的是( )

下列说法中正确的是( )
| A、30min~40min间该反应使用了催化剂 |
| B、反应方程式中的x=1,正反应为放热反应 |
| C、30min时降低温度,40min时升高温度 |
| D、8min前A的平均反应速率为0.08mol?L-1?min-1 |
m mol C2H2跟n mol HCl在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H3Cl.将反应后的混合气体完全燃烧,生成CO2、H2O和HCl,所需要氧气的物质的量是( )
| A、(3m+n)mol | ||||
B、(
| ||||
C、(3m+n-
| ||||
D、
|
2,2,6,6-四甲基庚烷的一氯取代物的同分异构体共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
不饱和脂肪酸是常见的保健品,DHA(分子式为C22H32O2)是近年来倍受关注的一元不饱和高级脂肪酸(分子中只含有双键),它对大脑细胞的生长发育具有重要意义,许多海洋生物食品含有丰富的DHA.则在一个DHA分子中含有的碳碳双键数为( )
| A、4个 | B、5个 | C、6个 | D、7个 |
下列说法正确的是( )
| A、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 |
| B、用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 |
| C、邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 |
| D、向某溶液中加入茚三铜试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质 |