题目内容
由铜片、锌片与200mL硫酸组成的原电池中,当在铜片上共放出0.15mol气体时,H2SO4恰好全部用完.
(1)写出该原电池的电极反应方程式.
(2)产生这些气体消耗锌多少克?
(3)所用硫酸的物质的量浓度是多少?
(1)写出该原电池的电极反应方程式.
(2)产生这些气体消耗锌多少克?
(3)所用硫酸的物质的量浓度是多少?
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑;
(2)根据转移电子相等计算锌的质量;
(3)根据H原子守恒计算硫酸的物质的量浓度.
(2)根据转移电子相等计算锌的质量;
(3)根据H原子守恒计算硫酸的物质的量浓度.
解答:
解:(1)该原电池中,Zn易失电子发生氧化反应而作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,电池反应式为Zn+2H+=Zn2++H2↑,答:负极电极反应式为Zn-2e-=Zn2+、正极电极反应式为2H++2e-=H2↑;
(2)生成1.5mol氢气转移电子的物质的量=0.15mol×2=0.3mol,根据转移电子相等得消耗Zn的质量=
×65g/mol=9.75g,答:消耗锌的质量为9.75g;
(3)H原子守恒得n(H2SO4)=n(H2)=0.15mol,C(H2SO4)=
=0.75mol/L,
答:硫酸的物质的量浓度是0.75mol/L.
(2)生成1.5mol氢气转移电子的物质的量=0.15mol×2=0.3mol,根据转移电子相等得消耗Zn的质量=
| 0.3mol |
| 2 |
(3)H原子守恒得n(H2SO4)=n(H2)=0.15mol,C(H2SO4)=
| 0.15mol |
| 0.2L |
答:硫酸的物质的量浓度是0.75mol/L.
点评:本题以原电池原理为载体考查了物质的量的有关计算,根据转移电子相等、原子守恒进行解答即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
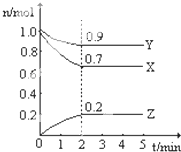 I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: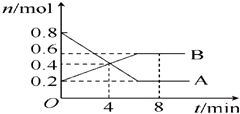
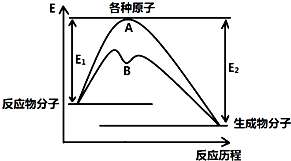 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
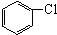 与
与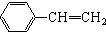 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为