题目内容
利用下列实验装置能完成相应实验的是( )
A、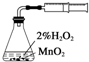 测定化学反应速率 |
B、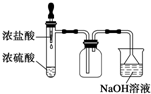 制取并吸收Cl2 |
C、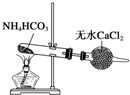 制备纯净的NH3 |
D、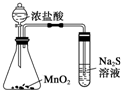 比较MnO2、Cl2、S的氧化性 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.测出一定时间内气体的体积,测定反应速率;
B.浓硫酸具有吸水性,浓盐酸易挥发,二者不反应;
C.无水氯化钙与氨气发生络合反应;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
B.浓硫酸具有吸水性,浓盐酸易挥发,二者不反应;
C.无水氯化钙与氨气发生络合反应;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答:
解:A.测出一定时间内气体的体积,测定反应速率,而图中装置只能测定气体的体积,不能确定时间,缺少计时器,故A错误;
B.浓硫酸具有吸水性,浓盐酸易挥发,二者不反应,不能生成氯气,故B错误;
C.无水氯化钙与氨气发生络合反应,不能干燥氨气,得不到纯净的氨气,故C错误;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,浓盐酸与二氧化硫反应生成氯气,氯气与硫化钠反应生成S,则氧化性为MnO2>Cl2>S,故D正确;
故选D.
B.浓硫酸具有吸水性,浓盐酸易挥发,二者不反应,不能生成氯气,故B错误;
C.无水氯化钙与氨气发生络合反应,不能干燥氨气,得不到纯净的氨气,故C错误;
D.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,浓盐酸与二氧化硫反应生成氯气,氯气与硫化钠反应生成S,则氧化性为MnO2>Cl2>S,故D正确;
故选D.
点评:本题考查化学实验方案的评价,涉及反应速率的测定、氧化性的比较、气体的制备等,为高频考点,把握物质的性质及实验原理为解答的关键,注意实验方案的操作性、合理性分析,选项C为解答的易错点,题目难度不大.

练习册系列答案
相关题目
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g)②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol?L-1,c(NH3)=4mol?L-1,则此温度下反应①的平衡常数为( )
①NH4I(s)?NH3(g)+HI(g)②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol?L-1,c(NH3)=4mol?L-1,则此温度下反应①的平衡常数为( )
| A、9 | B、12 | C、16 | D、20 |
下列微粒具有相同质子数和相同电子数的是( )
| A、CH4和OH- |
| B、H3O+和NH4+ |
| C、HS-和N2H4 |
| D、K+和Cl- |
Fe与硝酸反应随温度和硝酸的浓度不同而产物不同.已知0.2mol HNO3做氧化剂时,恰好把0.4mol Fe氧化为Fe2+,则HNO3将被还原成( )
| A、NH4+ |
| B、N2O |
| C、NO |
| D、NO2 |
分子式为C4H10O且能催化氧化成醛的醇有(不考虑立体异构)( )
| A、3种 | B、4种 | C、2种 | D、5种 |
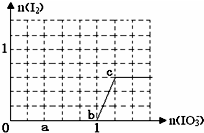 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b-c间I2是既是还原产物又是氧化产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |
X和Y两种元素可以形成XY2型化合物,则X和Y的原子序数为( )
| A、3和9 | B、6和8 |
| C、7和12 | D、10和14 |