题目内容
电化学在环境保护、工业生产等日常生活领域中起着十分重要的作用.
泡铜(Cu2O、Cu)Al高温粗铜精铜电解精炼
工业上由泡铜矿(主要成分Cu2O和Cu的混合物)冶炼铜的主要流程如下:
泡铜(Cu2O、Cu)
粗铜
精铜
(1)由泡铜冶炼粗铜的化学反应方程式为 .
(2)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 .
泡铜(Cu2O、Cu)Al高温粗铜精铜电解精炼
工业上由泡铜矿(主要成分Cu2O和Cu的混合物)冶炼铜的主要流程如下:
泡铜(Cu2O、Cu)
| Al |
| 高温 |
| 电解精炼 |
(1)由泡铜冶炼粗铜的化学反应方程式为
(2)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据信息:泡铜(Cu2O、Cu)和Al在高温下反应可以获得氧化铝和铜,据此书写方程式即可;
(2)根据电解精炼铜的原理以及电解池的工作原理来回答判断;
(3)根据原电池原理,正极发生的是化合价降低得电子的还原反应.
(2)根据电解精炼铜的原理以及电解池的工作原理来回答判断;
(3)根据原电池原理,正极发生的是化合价降低得电子的还原反应.
解答:
解:(1)泡铜(Cu2O、Cu)和Al在高温下反应可以获得氧化铝和铜,3Cu2O+2Al
Al2O3+6Cu,故答案为:3Cu2O+2Al
Al2O3+6Cu;
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,
A.电能只有部分转化为化学能,还有热能等能量的转化,故A错误;
B.电解时,粗铜接电源正极,作阳极,该极上发生氧化反应,故B正确;
C.电解池中的阳离子移向阴极,即溶液中Cu2+向阴极移动,故C错误;
D.不参与电极反应的Ag、Pt、Au等金属可以形成阳极泥,故从阳极泥中可回收Ag、Pt、Au等金属,故D正确.
故选BD.
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
| ||
| ||
(2)CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,
A.电能只有部分转化为化学能,还有热能等能量的转化,故A错误;
B.电解时,粗铜接电源正极,作阳极,该极上发生氧化反应,故B正确;
C.电解池中的阳离子移向阴极,即溶液中Cu2+向阴极移动,故C错误;
D.不参与电极反应的Ag、Pt、Au等金属可以形成阳极泥,故从阳极泥中可回收Ag、Pt、Au等金属,故D正确.
故选BD.
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
点评:本题考学生电解池的工作原理以及应用方面的知识,注意电解精炼铜的原理,难度不大.

练习册系列答案
相关题目
利用下列实验装置能完成相应实验的是( )
A、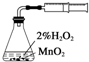 测定化学反应速率 |
B、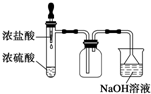 制取并吸收Cl2 |
C、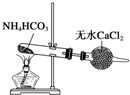 制备纯净的NH3 |
D、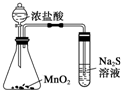 比较MnO2、Cl2、S的氧化性 |
下列反应的离子方程式书写正确的是( )
| A、硫酸铜溶液中加入铁粉反应:Cu2++Fe=Fe2++Cu |
| B、稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓ |
| D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
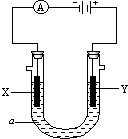 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: