题目内容
下列微粒具有相同质子数和相同电子数的是( )
| A、CH4和OH- |
| B、H3O+和NH4+ |
| C、HS-和N2H4 |
| D、K+和Cl- |
考点:质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:质子数等于各原子的质子数之和,中性微粒中质子数等于电子数,阳离子的电子数等于质子数减去电荷数,而阴离子的电子数为质子数加电荷数.
解答:
解:A、CH4的质子数为6+1×4=10,电子数为10,OH-的质子数为8+1=9,OH-的电子数为9+1=10,故A错误;
B、H3O+的质子数为8+1×3=11,电子数为11-1=10,NH4+的质子数为7+4=11,NH4+的电子数为11-1=10,故B正确;
C、HS-的质子数为1+16=17,电子数为17+1=18,N2H4的质子数为7×2+4×1=18,电子数为18,故C错误;
D、K+质子数为19,电子数为19-1=18,Cl-的质子数为17,电子数为17+1=18,故D错误;
故选:B.
B、H3O+的质子数为8+1×3=11,电子数为11-1=10,NH4+的质子数为7+4=11,NH4+的电子数为11-1=10,故B正确;
C、HS-的质子数为1+16=17,电子数为17+1=18,N2H4的质子数为7×2+4×1=18,电子数为18,故C错误;
D、K+质子数为19,电子数为19-1=18,Cl-的质子数为17,电子数为17+1=18,故D错误;
故选:B.
点评:本题考查微粒的质子数和电子数的关系,明确中性微粒、阳离子、阴离子的电子的数目计算是解答的关键,并注意中性微粒中质子数等于电子数.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
常温下能用铁罐或铝罐贮存的是( )
| A、浓H2SO4 |
| B、浓HCl |
| C、稀H2SO4 |
| D、稀HCl |
下列说法正确的是( )
| A、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 |
| B、使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 |
| C、检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| D、用10mL量筒量取9.2mL NaCl溶液 |
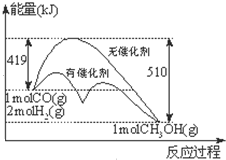 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |
下列说法正确的是( )
| A、两种元素组成的分子中一定只有极性键 |
| B、含有阴离子的化合物一定含有阳离子 |
| C、干冰升华时,分子内共价键会发生断裂 |
| D、金属元素和非金属元素形成的化合物一定是离子化合物 |
把一定量的锌与100mL 18.5mol/L的浓硫酸充分反应后,锌完全溶解,同时生成标准状况下 33.6L的气体,将反应后的溶液稀释到1L,测得溶液的pH=1,则下列叙述错误的是( )
| A、气体A中SO2和H2的体积比为4:1 |
| B、气体A是SO2和H2的混合物 |
| C、反应中共消耗锌97.5g |
| D、反应中共转移电子3 mol |
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述不正确的是( )
| A、电解时以精铜作阴极 |
| B、电解时阴极发生还原反应 |
| C、粗铜连接电源负极,其电极反应有:Cu-2e-=Cu2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+ |
| D、电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
利用下列实验装置能完成相应实验的是( )
A、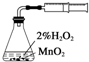 测定化学反应速率 |
B、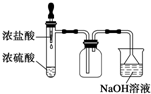 制取并吸收Cl2 |
C、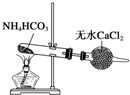 制备纯净的NH3 |
D、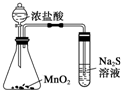 比较MnO2、Cl2、S的氧化性 |