题目内容
8.某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如图(图1):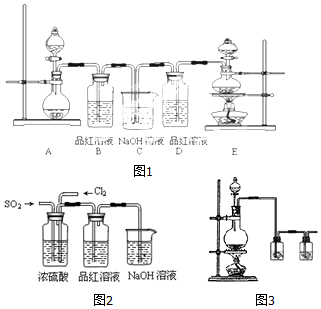
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
分析 (1)实验室制备氯气的反应原理:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据方程式可以判断浓盐酸的性质;
(2)二氧化硫能够与有机色素化合成无色物质使品红溶液褪色,但是该无色物质不稳定受热易回复颜色;氯气溶液水生成的次氯酸具有强的氧化性,直接将有色物质氧化成稳定的无色物质,其漂白效果好,受热不回复颜色;
(3)二氧化硫和氯气都是有毒气体需要进行尾气处理,以免污染空气;
(4)①氯气和二氧化硫在水溶液中恰好发生氧化还原反应,转化成没有漂白性的盐酸和硫酸,所以品红溶液几乎不褪色;
②当通入的二氧化硫或者氯气一方有剩余时,又会使品红溶液褪色;
(5)①由于排放出来的SO2等气体溶于水后生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,2H2SO3+O2=2H2SO4,从而使雨水的酸性增强;
②少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能有效地防止酸雨的形成;
(6)实验室制备得到氯气含水蒸气和氯化氢,第一个是通过饱和食盐水除去氯化氢.
解答 解:(1)根据反应方程式4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,4molHCl中有2mol盐酸中的氯元素化合价升高,做还原剂,表现还原性,还有2mol化合价不变与金属阳离子结合成盐表现出酸性,故答案为:酸性、还原性;
(2)二氧化硫漂白具有不稳定性受热回复颜色,次氯酸漂白效果稳定,受热不回复颜色,
故答案为:B中溶液又变为红色;
(3)用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,故答案为:除去多余的Cl2和SO2,防止污染空气;
(4)①氯气和二氧化硫在水溶液中恰好完全反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;
②当通入的二氧化硫或者氯气一方有剩余时,有具有漂白性,使品红褪色,故答案为:通入的二氧化硫或者氯气一方有剩余.
(5)①空气中存在CO2溶于水生成碳酸使雨水显酸性,正常雨水的pH值约等于5.6,雨水样品的PH变小的原因是由于排放出来的SO2气体溶于水后SO2+H2O?H2SO3生成H2SO3,H2SO3随雨水的下降,逐渐被空气中的氧气所氧化生成易电离的H2SO4,.2H2SO3+O2=2H2SO4,从而使雨水的酸性增强,该反应过程也可用或2SO2+2H2O+O2=2H2SO4表示,
故答案为:2H2SO3+O2=2H2SO4;
②把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能从源头有效地防止酸雨的形成,少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,故选ACE
故答案为:ACE;
(6)实验室制备得到氯气含水蒸气和氯化氢,第一个是通过饱和食盐水除去氯化氢,第二个是浓硫酸除去水蒸气,
故答案为:饱和食盐水.
点评 本题通过实验考查了二氧化硫和次氯酸的漂白性的区别、酸雨的有关知识,题目比较简单,注意记住常见的几种漂白剂及其漂白的原理,二氧化硫是有毒的气体,排放到空气中会造成空气污染,应减少二氧化硫的排放.

| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
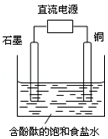 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |
| A. | 苯中含有少量甲苯 | B. | 乙醇中含有少量乙酸 | ||
| C. | 溴苯中含有少量苯 | D. | 乙酸乙酯中含有少量乙酸 |
| A. | 乙炔 | B. | 乙烯 | C. | 丁二烯 | D. | 丙炔 |
| A. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△H>0,△S>0 | |
| B. | 铅酸蓄电池放电时,负极质量减少,正极质量增加 | |
| C. | 向Na2S溶液中加入少量NaOH固体后,溶液中c(Na+)/c(S2- )减少 | |
| D. | 向平衡体系CH3COOH+C2H5OH?CH3COOC2H5+H2O中,加少量浓硫酸,乙酸转化率不变 |
| A. | Na2O2固体中阳离子与阴离子的个数比为1:1 | |
| B. | 从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中 | |
| C. | 将Na投入饱和Na2CO3溶液中,会导致溶液质量增加 | |
| D. | 金属Na失火,可用CO2灭火 |