题目内容
19.下列离子方程式正确的是( )| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.碘离子还原性强于二价铁离子,溴离子先氧化碘离子;
B.设银离子、铜离子都是2mol,则消耗镁粉物质的量为3mol,置换铜和银;
C.氢氧化铁溶于氢碘酸中,发生氧化还原反应生成碘化亚铁、碘、水;
D.沉淀最多时为铝离子全部生成沉淀时.
解答 解:A.向碘化亚铁溶液中滴加溴的四氯化碳溶液,离子方程式:3Br2+2Fe2++4I-═3I2+6Br-+2Fe3+,故A错误;
B.向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉:2Cu2++2Ag++3Mg═2Cu+2Ag+3Mg2+,故B错误;
C.氢氧化铁溶于氢碘酸中的离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故C正确;
D.明矾为KAl(SO4)2?12H2O,1mol明矾加入1.5molBa(OH)2溶液生成沉淀的物质的量最多,反应的离子方程式为2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓+3H2O,故D错误;
故选C.
点评 本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及氧化还原、物质的用量的多少判断是否符合反应实际情况.

练习册系列答案
相关题目
9.下列说法中正确的一组是( )
| A. |  互为同分异构体 互为同分异构体 | |
| B. |  与 与 两种烃互为同系物 两种烃互为同系物 | |
| C. | 甲苯与溴蒸汽的反应产物受反应条件的影响而不同 | |
| D. | H2和D2互为同位素 |
10.美国天文学家在亚利桑那州一天文观测台探测到了距银河系中心2.6亿光年处一巨大气云中的特殊电磁波这种电磁波表明那里可能有乙醇醛糖分子存在.下列有关乙醇醛糖(HOCH2CHO)的说法不正确的是( )
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应和还原反应 | |
| B. | 乙醇醛糖属于醛和糖的混合物 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质 |
7.下列物质水溶液呈碱性并能促进水电离的是( )
| A. | AlCl3 | B. | NaOH | C. | HCl | D. | Na2CO3 |
14.用 NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 44g CO2含有的原子数目为 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100mL12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18mL 水含有的分子数目约为 NA |
4.在某100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4mol•L-1、0.1mol•L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol•L-1)是( )
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
8.某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如图(图1):
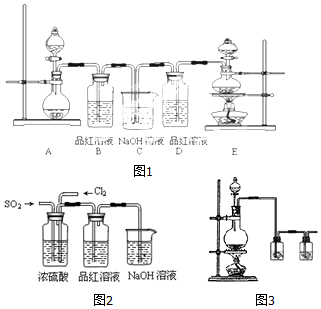
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.

(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
10.A、B、D、E、F为短周期元素.非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2;c的电子式为 ;d的晶体类型是金属.
;d的晶体类型是金属.
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属. 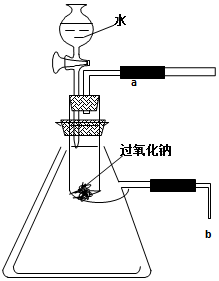 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.