题目内容
3. 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |
分析 电解饱和食盐水的装置如图,通电后两极均有气泡产生,则Cu为阴极,石墨为阳极,Cu与电源负极相连,结合阳极发生氧化反应、阴极发生还原反应来解答.
解答 解:根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,该极上的反应:2H++2e-=H2↑,阳极上是氯离子失电子,发生的电极反应为:2Cl--2e-=Cl2↑;
A.金属铜电极一定是阴极,故A错误;
B.石墨电极是阳极,该电极附近发生的电极反应为:2Cl--2e-=Cl2↑,可以观察到黄绿色气体产生,故B错误;
C.金属铜电极上的反应为2H++2e-=H2↑,铜电极附近观察到无色气体,故C正确;
D.石墨电极是阳极,该极上的反应为氧化反应,故D错误;
故选C.
点评 本题考查电解池的工作原理,为高频考点,把握两个电极均生成气体、电极判断及电极反应书写为解答的关键,侧重分析与应用能力的考查,注意Cu若为阳极失去电子生成铜离子,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 无色溶液中:Na+、Cl-、SO42-、Cu2+ | |
| B. | 滴加紫色石蕊试液显红色的溶液:NH4+、Fe2+、SO42-、NO3- | |
| C. | 滴加酚酞显红色的溶液:K+、Ba2+、Cl-、NO32- | |
| D. | 含有大量HS-的溶液:NH4+、Ca2+、H+、I- |
14.用 NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 44g CO2含有的原子数目为 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100mL12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18mL 水含有的分子数目约为 NA |
18.下列现象不能用“相似相溶”解释的是( )
| A. | 二氧化硫易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
8.某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如图(图1):
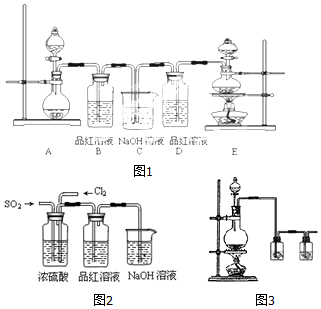
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.

(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
15.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 氯化硼分子间含有氢键 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈正三角形,属非极性分子 | |
| D. | 其分子空间结构类似CH4O |
12.处理燃烧产生的烟道气CO和SO2,方法之一是在一定条件下将其催化转化为CO2和S.
已知:
①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
②S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法中正确的是( )
已知:
①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
②S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法中正确的是( )
| A. | 转化①有利于碳参与自然界的元素循环 | |
| B. | 转化②中S和O2属于不同的核素 | |
| C. | 可用澄清的石灰水鉴别CO2与SO2 | |
| D. | 转化的热化学方程式是:2CO(g)+SO2(g)═S(s)+2CO2 (g)△H=+270kJ/mol |
 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.


