题目内容
18.常温下,将22.4gCu和Fe2O3的混合物粉末加入到浓度为1mol/L的H2SO4中,使之发生反应.(1)若固体刚好完全溶解,消耗H2SO4的体积为VL,求V的取值范围.
(2)若H2SO4溶液过量,反应后溶液体积为1L,测得此溶液中Fe2+离子浓度为0.1mol/L,求原混合物中含Cu多少克?
分析 (1)若固体恰好全部溶解,发生反应Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O、Cu+Fe2 (SO4)3=2FeSO4+CuSO4,总反应方程式为Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O,
若Cu、Fe2O3按物质的量1:1混合,消耗的硫酸最少,若混合物粉末全是Fe2O3,消耗的硫酸最多,结合方程式计算解答;
(2)硫酸溶液过量,若铜过量,过量的铜不与硫酸反应,则只发生如下反应:Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O,根据溶液中n(Fe2+)计算n(Fe2O3),进而计算Cu的质量;
若Fe2O3过量,过量的Fe2O3将与H2SO4反应,根据溶液中n(Fe2+)计算Cu的质量.
解答 解:(1)若固体恰好全部溶解,铜粉和三氧化二铁的混合物是按如下反应进行:
Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O、Cu+Fe2 (SO4)3=2FeSO4+CuSO4
总反应方程式为:Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O,
Cu、Fe2O3按物质的量1:1混合,消耗的硫酸最少,则n(Cu)=n(Fe2O3)=$\frac{22.4g}{64g/mol+160g/mol}$=0.1mol,由方程式可知,需要硫酸为0.1mol×3=0.3mol,硫酸体积为$\frac{0.3mol}{1mol/L}$=0.3L,
若混合物粉末全是Fe2O3,消耗的硫酸最多,则发生:Fe2O3+3H2SO4=Fe2 (SO4)3+3H2O,n(Fe2O3)=$\frac{22.4g}{160g/mol}$=0.14mol,故消耗H2SO4为0.14 mol×3=0.42 mol,硫酸体积为$\frac{0.42mol}{1mol/L}$=0.42L
但铜的质量不可能为0,故有0.3L≤V<0.42L,
答:范围为0.3L≤V<0.42L;
(2)溶液中n(Fe2+)=1L×0.1mol/L=0.1mol,则
Cu+Fe2O3+3H2SO4=CuSO4+2FeSO4+3H2O
0.05 0.05 0.1
若铜过量,过量的铜不与硫酸反应,则m (Fe2O3)=0.05 mol×160 g/mol=8.0 g,故m (Cu)=22.4 g-8.0 g=14.4 g;
若Fe2O3过量,过量的Fe2O3将与H2SO4反应,则m (Cu)=0.05mol×64 g/mol=3.2g,
答:含Cu为3.2或14.4
点评 本题考查混合物的有关计算,属于讨论型题目,利用总方程式简化分析与计算,注意(1)中利用极端法确定极值,(2)中不能确定铁离子与Cu是否恰好反应.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. |  互为同分异构体 互为同分异构体 | |
| B. |  与 与 两种烃互为同系物 两种烃互为同系物 | |
| C. | 甲苯与溴蒸汽的反应产物受反应条件的影响而不同 | |
| D. | H2和D2互为同位素 |
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
| A. | 无色溶液中:Na+、Cl-、SO42-、Cu2+ | |
| B. | 滴加紫色石蕊试液显红色的溶液:NH4+、Fe2+、SO42-、NO3- | |
| C. | 滴加酚酞显红色的溶液:K+、Ba2+、Cl-、NO32- | |
| D. | 含有大量HS-的溶液:NH4+、Ca2+、H+、I- |
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应和还原反应 | |
| B. | 乙醇醛糖属于醛和糖的混合物 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质 |
| A. | AlCl3 | B. | NaOH | C. | HCl | D. | Na2CO3 |
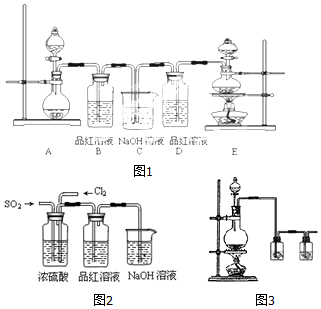
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
 .
.