题目内容
17.下列说法正确的是( )| A. | 反应C(s)+H2O(g)═CO(g)+H2(g)的△H>0,△S>0 | |
| B. | 铅酸蓄电池放电时,负极质量减少,正极质量增加 | |
| C. | 向Na2S溶液中加入少量NaOH固体后,溶液中c(Na+)/c(S2- )减少 | |
| D. | 向平衡体系CH3COOH+C2H5OH?CH3COOC2H5+H2O中,加少量浓硫酸,乙酸转化率不变 |
分析 A.C(s)+H2O(g)═CO(g)+H2(g)为吸热反应,且生成物为气体;
B.铅酸蓄电池放电时,正极、负极都生成硫酸铅;
C.向Na2S溶液中加入少量NaOH固体,钠离子的物质的量增大;
D.加少量浓硫酸,浓硫酸具有吸水性,有利于平衡正向移动.
解答 解:A.C(s)+H2O(g)═CO(g)+H2(g)为吸热反应,则△H>0,且生成物为气体,气体体积增大,则△S>0,故A正确;
B.铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以正负极质量都增大,故B错误;
C.向Na2S溶液中加入少量NaOH固体,钠离子的物质的量增大,且增大倍数大于c(S2- ),则二者比值增大,故C错误;
D.加少量浓硫酸,浓硫酸具有吸水性,有利于平衡正向移动,则乙酸的转化率增大,故D错误.
故选A.
点评 本题考查较为综合,涉及反应热与焓变、化学平衡、原电池等知识,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握化学反应原理的相关基础知识,易错点为C,注意盐类的水解影响因素,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
7.下列物质水溶液呈碱性并能促进水电离的是( )
| A. | AlCl3 | B. | NaOH | C. | HCl | D. | Na2CO3 |
8.某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如图(图1):
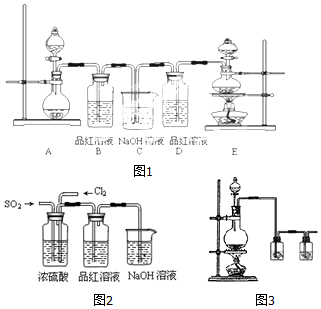
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.

(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
12.处理燃烧产生的烟道气CO和SO2,方法之一是在一定条件下将其催化转化为CO2和S.
已知:
①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
②S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法中正确的是( )
已知:
①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
②S(g)+O2(g)═SO2(g)△H=-296.0kJ/mol
下列说法中正确的是( )
| A. | 转化①有利于碳参与自然界的元素循环 | |
| B. | 转化②中S和O2属于不同的核素 | |
| C. | 可用澄清的石灰水鉴别CO2与SO2 | |
| D. | 转化的热化学方程式是:2CO(g)+SO2(g)═S(s)+2CO2 (g)△H=+270kJ/mol |
3.已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
请回答下列问题:
(1)该反应平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;△H<0(选填“>”、“<”或“=”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若测得反应初始至6S内A的平均反应速率v(A)=0.002mol•L-1•S-1,则6S时c(A)=0.028 mol•L-1;C的物质的量为0.06mol.
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为80%;保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,此时A的转化率为80%;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率不变(选填“增大”、“减小”、“不变”).
(4)判断该反应是否达到平衡的依据为ce(填正确选项的字母).
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$;△H<0(选填“>”、“<”或“=”).
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,若测得反应初始至6S内A的平均反应速率v(A)=0.002mol•L-1•S-1,则6S时c(A)=0.028 mol•L-1;C的物质的量为0.06mol.
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为80%;保持温度、容器不变,再向密闭容器中充入0.20mol的A和0.80mol的B,此时A的转化率为80%;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率不变(选填“增大”、“减小”、“不变”).
(4)判断该反应是否达到平衡的依据为ce(填正确选项的字母).
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(5)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.
10.A、B、D、E、F为短周期元素.非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.回答下列问题:
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为NaH;b的化学式为Na2O2;c的电子式为 ;d的晶体类型是金属.
;d的晶体类型是金属.
(1)写出工业制备单质F的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其水溶液与F单质反应的化学方程式为2Na2CO3+Cl2+H2O═NaCl+NaClO+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属.