题目内容
16.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述中正确的是( )| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
分析 在短周期主族元素中,元素的最高正化合价与其族序数相等,非金属元素负化合价数值=族序数-8,原子的电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小;
A属于ⅠA族,则A是Na元素、
B属于第IIIA族元素,A原子半径大于B,则B是Al元素;
D、E最低负价是-2价,则二者属于第VIA族元素,D有正化合价,则D为S元素、E为O元素,
C属于第IIA族元素,原子半径大于E小于D,C是Be元素,
以此解答该题.
解答 解:由以上分析可知A为Na、B为Al、C为Be、D为S、E为O元素.
A.金属性Na>Be,最高价氧化物对应水化物的碱性Na<Be,故A错误;
B.非金属性S<O,则O对应的氢化物稳定,故B正确;
C.金属性Na>Al,钠与盐酸反应较剧烈,故C错误;
D.钠离子比铍多一个电子层,故D错误.
故选B.
点评 本题考查了原子结构和元素性质,为高频考点,明确元素化合价、原子半径与原子结构的关系是解本题关键,再结合元素周期律分析解答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
6.某硫酸铝溶液中,含 Al3+ a g,则溶液中 SO42- 的物质的量为( )
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
7.下列物质水溶液呈碱性并能促进水电离的是( )
| A. | AlCl3 | B. | NaOH | C. | HCl | D. | Na2CO3 |
4.在某100mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4mol•L-1、0.1mol•L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol•L-1)是( )
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
1.在以下性质的比较中,正确的是( )
| A. | 微粒半径:Li+<O2-<F-<Na+ | B. | 电负性:F>N>O>C | ||
| C. | 分子中的键角:CO2>H2O>CH4>NH3 | D. | 共价键的键能:H-F>H-Cl>H-Br>H-I |
8.某中学化学实验小组为了证明和比较SO2与氯水的性质,设计了如图(图1):
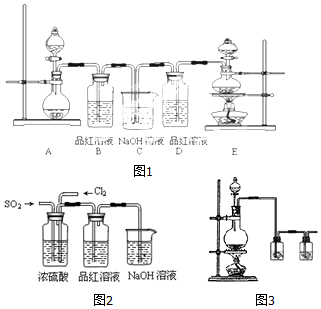
(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.

(1)实验室常用装置E制备Cl2,反应中浓盐酸所表现出的性质是酸性、还原性.
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D加热,B中的现象为:B中溶液又变为红色.
(3)装置C的作用是除去多余的Cl2和SO2,防止污染空气.
(4)该实验小组的甲、乙两位同学利用上述两发生装置按图2装置继续进行实验:通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用方程式表示):Cl2+SO2+2H2O═2HCl+H2SO4.
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?通入的二氧化硫或者氯气一方有剩余.
(5)二氧化硫容易造成酸雨,现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②你认为减少酸雨产生的途径可采用的措施是ACE.
A.少用煤作燃料 B.把工厂烟囱造高
C.燃料脱硫 D.在已酸化的土壤中加石灰 E.开发新能源
(6)实验中需要用干燥纯净的氯气,下列装置图3第一个洗气瓶中盛放的液体为饱和食盐水.
 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.