题目内容
2.大多数城市的空气质量实时发布系统将以实时空气质量指数替代原料的AQI指数,燃煤烟气和汽车尾气是引发AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
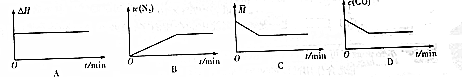
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
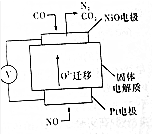
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
分析 (1)提高NO的转化率,又能提高反应速率,说明反应速率加快且反应正向移动,根据影响化学平衡的因素分析;
(2)依据反应速率V=$\frac{△c}{△t}$计算一氧化碳的反应速率,结合反应速率之比等于化学方程式计量数之比计算氮气的反应速率,转化率=$\frac{转化量}{起始量}$×100%;
(3)根据图得到平衡时各物质的浓度,再代入化学平衡常数计算可得;
(4)A、反应热与反应进程无关,B、v(N2) 随着反应的进行增大,C、根据$\overline{M}=\frac{m}{n}$判断,D、n(CO)随着反应的进行减小;
(5)①根据Ka越大酸性越强,根据酸性较强的能与酸性较弱的酸根离子反应;
②铵根离子水解,但水解部分非常少,先按铵根离子数目分组,同组内,按抑制水解、水解、促进水解排序可得;
③NO在铂丝电极发生还原反应,做正极,得电子生成氮气;CO在氧化镍电极发生氧化反应,做负极,失电子生成二氧化碳.
解答 解:(1)该可逆反应的特点是:正反应是气体分子数减小的反应,也是放热反应,增大压强,反应速率增大,NO的转化率增大,A正确,升高温度,平衡逆向移动,NO的转化率减小,B错误,加催化剂,不改变NO的转化率,C错误,降低温度,反应速率减小,D错误;
故答案为:A;
(2)前2s内的平均反应速率v(CO2)=v(CO)=$\frac{3.65×1{0}^{-3}-2.85×10{\;}^{-3}}{2s}$=3.75×10-4mol/(L•s);CO的平衡转化率=$\frac{3.60×1{0}^{-3}-2.70×1{0}^{-3}}{3.60×1{0}^{-3}}$×100%=25%;
故答案为:3.75×10-4mol/(L•s);25%;
(3)由图可知,
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始浓度:1.0×10-3 3.6×10-3 0 0
转化浓度:9.0×10-4 9.0×10-4 4.5×10-4 9.0×10-4
平衡浓度:1.0×10-4 2.7×10-3 4.5×10-4 9.0×10-4
故化学平衡常数K=$\frac{(9.0×1{0}^{-4})^{2}×4.5×1{0}^{-4}}{(1×1{0}^{-4})^{2}×(2.7×1{0}^{-3})^{2}}$=5000;
故答案为:5000;
(4)反应热只与化学计量数有关,与反应进程无关,A错误;氮气的体积分数由0逐渐增大至不变,到平衡状态,B正确;混合气体的总质量不变,总的物质的量不变,则$\overline{M}=\frac{m}{n}$由小到大至不变,C错误;在密闭容器中,一氧化碳的浓度由大变小至不变,到平衡状态,D正确;
故答案为:BD;
(5)①已知Ka越大酸性越强,酸性较强的能与酸性较弱的酸根离子反应,H2SO3>H2CO3>HSO3->HCO3-,由于HCO3-的酸性小于H2SO3的酸性,CO32-的酸性小于HSO3-的酸性,即CD不能共存;
故答案为:CD;
②等物质量浓度的5种溶液:b(NH4)2SO4、c(NH4)2CO3铵根离子浓度是其他物质的两倍,故较大,碳酸根离子水解,与铵根离子的水解相互促进,故b>c,同理a.NH4Cl、d.NH4Al(SO4)2、e.CH3COONH4,铝离子抑制铵根离子的水解,醋酸跟离子促进铵根离子的水解,故d>a>e;
故答案为:b>c>d>a>e;
③NO在铂丝电极发生还原反应,做正极,得电子生成氮气,电极反应式为:2NO+4e-=N2+2O2-;CO在氧化镍电极发生氧化反应,做负极,失电子生成二氧化碳,发生的电极反应式为:CO+O2--2e-=CO2;
故答案为:正极;CO+O2--2e-=CO2.
点评 本题考察了化学平衡点的有关计算、化学平衡状态的特征、电离常数的应用、水解平衡、原电池的电极反应式,侧重于考查学生的分析能力和对基础知识的综合应用能力,知识点较多,综合性很强,题目难度较大.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
| A. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 逆反应速率増大,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 逆反应速率减小,正反应速率増大,平衡向正反应方向移动 |
| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
| A. | K+ Cl- MnO4- SO42- | B. | Na+ CO32- NO3- SO42- | ||
| C. | Na+ NO3- SO42- HCO3- | D. | Mg2+ SO42- S2- Cl- |
 氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
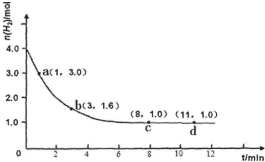 工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.
工业合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0某实验将3.0mol N2(g)和4.0mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应.测得H2的物质的量随反应时间的变化如图所示.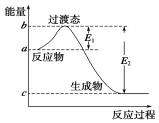 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.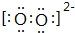 .
.