题目内容
11. W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物.(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛.则W为SiO2(填化学式).
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象.
往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色;往上层溶液中滴入KSCN溶液,溶液呈红色.
①W溶液中所含金属阳离子为Fe2+
②上述实验中,W与足量氯水反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1.
①阴离子的电子式为
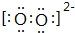 .
.②1mol W与足量水充分反应,转移电子的物质的量为1mol
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸.
①B在元素周期表中的位置为第二周期VIA族
②如果A元素的周期序数是B元素的两倍,W的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O
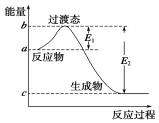
(5)若如图表示0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化.则该反
应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=2(E1-E2)KJ/mol.
分析 (1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2;
(4)①若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化生成H2SeO4;
(5)0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g),原子守恒和氧化还原反应电子守恒可知W为NO2,能量变化可知为放热反应反应焓变△H=E1-E2,结合热化学方程式书写方法写出.
解答 解:(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2,该反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2 ;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2.
①W溶液中所含金属阳离子为:Fe2+,故答案为:Fe2+;
②W(FeI2)与足量氯水反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2.
①CaO2中阴离子的电子式为: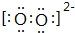 ,故答案为:
,故答案为: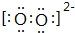 ;
;
②发生反应:2CaO2+2H2O=2Ca(OH)2+O2↑,反应中CaO2既是氧化剂又是还原剂,1mol CaO2与足量水充分反应生成0.5mol氧气,转移电子的物质的量为0.5mol×2=1mol,故答案为:1;
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
①氧元素处于周期表中第二周期VIA族,故答案为:第二周期VIA族;
②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O,
故答案为:H2SeO3+H2O2=H2SeO4+H2O;
(5)0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g),碳元素化合价+2价升高到+4价,电子转移=0.5mol×2=1mol,则0.5molW (g)中氮元素化合价变化降低,变化过程中的电子转移=1mol=(4-2)×0.5mol=1mol,W为NO2,能量变化可知为放热反应反应焓变△H=E1-E2,1molNO2和 1molCO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=$\frac{{E}_{1}-{E}_{2}}{0.5}$KJ/mol/L=2(E1-E2)KJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=2(E1-E2)KJ/mol.
点评 本题考查无机物推断、物质性质、电子式和热化学方程式书写,侧重考查特殊组成物质的性质,属于并列型题目,需要学生熟练掌握元素化合物性质,难度中等.

①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
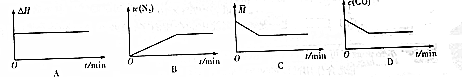
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
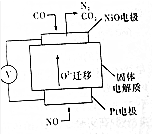
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于表中:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
E.容器中混合气体的平均相对分子质量不变
②用某气体组分(B)的平衡压强(pB)代替气体组分(B)的物质的量浓度(cB)也可以表示平衡常数(记作KP),气体组分(B)的平衡压强(pB)等于混合气体的总压乘以该气体的物质的量分数.根据表中数据,计算 25.0℃时氨基甲酸铵分解的平衡常数Kp=256(kPa)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念. 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.