题目内容
3.恒温时,在密闭容器中进行可逆反应:N2+3H2?2NH3,达到平衡后,欲使正反应速率增大,可采取的措施是( )| A. | 缩小容器的容积 | |
| B. | 保持容器的容积不变,通入稀有气体 | |
| C. | 保持容器内压强不变,通入稀有气体 | |
| D. | 及时把生成的NH3分离出去 |
分析 恒温条件下,达到平衡后,欲使正反应速率增大,可以通过增大反应物浓度、升高温度、增大压强、加入催化剂等方法实现.
解答 解:A.缩小容器容积,增大压强,增大单位体积内活化分子个数,正反应速率增大,故A正确;
B.保存容器的容积不变,通入稀有气体,反应物浓度不变,则正反应速率不变,平衡不移动,故B错误;
C.保持容器内压强不变,通入稀有气体,容器体积增大,反应物浓度降低,正反应速率减小,故C错误;
D.及时把氨气分离出去,生成物浓度减小,平衡正向移动,正反应速率减小,故D错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生分析判断能力,注意:改变压强时必须能引起反应物或生成物浓度改变的才能改变化学反应速率,否则不影响化学反应速率,注意比较BC选项区别,题目难度不大.

练习册系列答案
相关题目
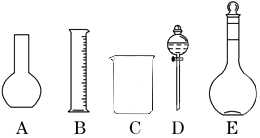
13. 进行化学实验必须注意安全,下列说法中正确的组合是( )
进行化学实验必须注意安全,下列说法中正确的组合是( )
①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
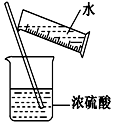
⑤稀释浓硫酸的操作如图所示.
 进行化学实验必须注意安全,下列说法中正确的组合是( )
进行化学实验必须注意安全,下列说法中正确的组合是( )①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
⑤稀释浓硫酸的操作如图所示.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①②③④⑤ |
11.200mL5mol/L的Na2CO3溶液中,含有的Na+数是( )
| A. | 1 | B. | 2 | C. | 6.02×1023 | D. | 1.204×1024 |
2.大多数城市的空气质量实时发布系统将以实时空气质量指数替代原料的AQI指数,燃煤烟气和汽车尾气是引发
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
(1)下列措施既能提高NO的转化率,又能提高反应速率的是A(填字母)
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
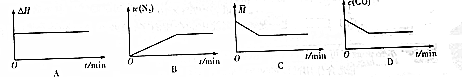
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD
(5)①已知
根据表中提供的数据可知,在溶液中不能大量共存的微粒是CD
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.
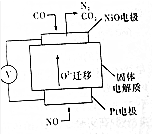
①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
AQI指数上升的主要污染源,因此,对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的,汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)?N2(g)+2CO(g)△H<0,一定条件下用气体传感器测得该反应在不同时间的NO和CO的浓度如下表
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
A.增大压强 B.上高温度C.加催化剂 D.降低温度
(2)前2 s内的平均反应速率v(CO2)=3.75×10-4mol/(L•s),CO平衡转化率为25%
(3)该反应的平衡常数K为5000
(4)在恒温密闭容器中充入CO、NO气体,下列图象如图能正确表面可逆反应达到平衡状态的是BD

(5)①已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
A.HCO3-、HSO3-
B.HCO3-、SO32-
C HCO3-、H2SO3
D.HSO3-、CO32-
②等物质量浓度的5种溶液:
a.NH4Cl
b.(NH4)2SO4
c.(NH4)2CO3
d.NH4Al(SO4)2
e.CH3COONH4.
c(NH4+)由大到小的顺序是b>c>d>a>e(填字母)
(6)设计如图装置模拟传感器测定CO与NO的反应原理.

①铂丝电极为正极(填“正极”或“负极”)
②负极反应式为CO+O2--2e-=CO2.
9.二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等.请回答:
(1)已知2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的关键反应.如图1为不同温度(T1、T2)下SO2的转化率随时间的变化曲线.
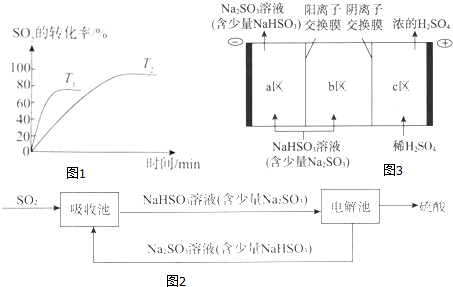
①T1>(填“>”“<”或“=”)T2,判断的依据是温度越高反应速率越快,达到化学平衡的时间越短;该反应为放(填“放”或“吸”)热反应,判断的依据是温度升高时平衡向吸热方向移动,SO2的转化率减小.
②如表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率.
i.b对应的投料比为4:15.
ii.投料比为8:10时,平衡混合气体中SO3体积分数为50%.
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如图2:
①吸收池中发生反应的离子方程式是SO2+SO32-+H2O=2HSO3-.
②电解池的构造示意图如图3:
i.在图中标示出b区的Na+和HSO3-的移动方向.
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:SO2.
(1)已知2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的关键反应.如图1为不同温度(T1、T2)下SO2的转化率随时间的变化曲线.

①T1>(填“>”“<”或“=”)T2,判断的依据是温度越高反应速率越快,达到化学平衡的时间越短;该反应为放(填“放”或“吸”)热反应,判断的依据是温度升高时平衡向吸热方向移动,SO2的转化率减小.
②如表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率.
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
ii.投料比为8:10时,平衡混合气体中SO3体积分数为50%.
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如图2:
①吸收池中发生反应的离子方程式是SO2+SO32-+H2O=2HSO3-.
②电解池的构造示意图如图3:
i.在图中标示出b区的Na+和HSO3-的移动方向.
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:SO2.
6.在三个体积相同的密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的是( )
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
7.有NO、CO2、N2O4三种气体,它们分别都含有0.5mol氧原子,则三种气体的物质的量之比为( )
| A. | 1:2:4 | B. | 1:1:1 | C. | 4:2:1 | D. | 1:2:4 |